1、选择题 对Na、Mg、Al的有关性质的叙述正确的是
A.碱性:NaOHMg>Al
D.还原性:Na>Mg>Al
参考答案:D
本题解析:考查元素周期律的应用。金属性越强,最高价氧化物的 水化物的碱性越强,金属性是Na>Mg>Al,所以选项A不正确,D正确;金属性越强,第一电离能越小,同样电负性也是越小的,因此选项BD都是错误的,答案选D。
本题难度:一般
2、选择题 根据元素周期律对工农业生产的指导作用,可在非金属元素区域中寻找( )
A.制新农药的元素
B.半导体元素
C.催化剂
D.耐腐蚀耐高温的合金材料
参考答案:A.非金属元素区的Cl、P、As等可应用于制新农药,故A选;
B.在金属元素与非金属元素的交界处寻找半导体元素,故B不选;
C.在过渡元素区的金属中寻找催化剂,故C不选;
D.在过渡元素区的金属元素中寻找耐腐蚀耐高温的合金材料,故D不选;
故选A.
本题解析:
本题难度:简单
3、选择题 X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M,X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素),下列说法正确的是
[? ]
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.氢化物的稳定性Z>X>Y
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
参考答案:D
本题解析:
本题难度:一般
4、选择题 根据下表信息,判断以下叙述正确的是
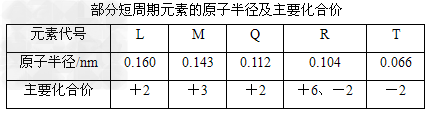
[? ]
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
参考答案:C
本题解析:
本题难度:一般
5、选择题 已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列说法正确的是
[? ]
A.原子半径:A > B > D > C
B.原子序数:d>c>b>a
C.离子半径:C>D>B>A
D.单质的还原性:A > B > D > C
参考答案:C
本题解析:
本题难度:一般