1、选择题 砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述不正确的是( )
A.KAt核间距大于KBr
B.砹在常温下为有色固体
C.NaAt熔点较高
D.砹易溶于水难溶于四氯化碳
参考答案:A.卤族元素从上到下,电子层数增多,半径增大,则KAt核间距大于KBr,故A正确;
B.卤族元素从上到下,单质的颜色逐渐加深,熔沸点逐渐增大,则砹是有色固体,故B正确;
C.卤族元素与钠形成的化合物为离子化合物,熔点高,故C正确;
D.砹单质属于非极性分子,不易溶于水,易溶于非极性的有机溶剂,故D错误.
故选D.
本题解析:
本题难度:一般
2、填空题 下表是周期表中的一部分,根据A-I在周期表中的位置,
?族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
1
A
2
D
E
G
I
3
B
C
F
H
|
用元素符号或化学式回答下列问题:
(1)元素化学性质最不活泼的是______,氧化性最强的单质是______.
(2)最高价氧化物的水化物碱性最强的是______,呈两性的是______;它们之间反应的离子方程式为:______.
(3)A分别与E、G、H形成的化合物中,最稳定的______;
(4)A、B两元素形成的化合物的电子式是______.
参考答案:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,
(1)以上元素中,只有Ne的最外层电子为8,为稳定结构,则化学性质不活泼,F的非金属性最强,则F2的氧化性最强,故答案为:Ne;F2;
(2)上述元素中,Na的金属性最强,则最高价氧化物的水化物NaOH的碱性最强,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,
二者反应的离子反应为Al(OH)3 +OH-═AlO2-+2H2O,故答案为:NaOH;Al(OH)3;Al(OH)3 +OH-═AlO2-+2H2O;
(3)N、Cl、F中F的非金属性最强,则HF最稳定,故答案为:HF;
(4)A、B两元素形成的化合物NaH,为离子化合物,其电子式为
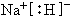
,故答案为:
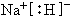
.
本题解析:
本题难度:简单
3、选择题 前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种
[? ]
A.3种
B.4种
C.5种
D.6种
参考答案:C
本题解析:
本题难度:简单
4、选择题 下表列举的各组事实中存在因果关系的是
[? ]
陈述I(原因)
陈述Ⅱ(结果)
A.
O3能吸收紫外线?
大气层中的O3被称为地球保护伞
B.
钠原子核外电子数比铝少
钠的金属性比铝强
C.
氯的非金属性比碘强
酸性:氢碘酸强于盐酸
D.
N2+3H2 2NH3是放热反应?
2NH3是放热反应?
工业合成氨的反应在高温下进行
参考答案:A
本题解析:
本题难度:一般
5、填空题 A、B、C三元素原子的核外电子数都比氩原子少,A和C处于同主族,两者间隔一周期,A元素和B元素的原子两者核电荷数之差为5,B原子核外第3电子层比第2电子层少两个电子。
(1)则B的原子结构示意图为___________;A离子的结构示意图为___________;
(2)B与C形成化合物的化学式是___________,它的电子式是___________它属于___________化合物(填“离子”或“共价”);A与B形成化合物的化学式是____________,它的电子式是_____________,它属于__________化合物。
参考答案:(1)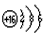 ;
;
(2)H2S; ;共价;Na2S;
;共价;Na2S;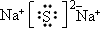 ;离子
;离子
本题解析:
本题难度:一般