1、选择题 室温下向10 mL c(H+)=10-3 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中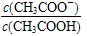 变大
变大
C.醋酸的电离程度增大,c(OH-)亦增大
D.再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
参考答案:BC
本题解析:A选项加水稀释电离平衡正移,导电离子数目增加,错误。B选项因为平衡正移,正确。C选项稀释平衡正移,电离度增大,c(H+)减小,c(OH-)亦增大,正确。D选项若与醋酸发生恰好完全反应,NaOH应大于10ml,错误。
本题难度:一般
2、选择题 用蒸馏水逐步稀释0.2 mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-)
B.c(NH4+)
C.c(NH3·H2O)
D.c(NH4+)/c(NH3·H2O)
参考答案:D
本题解析:氨水是弱碱,存在电离平衡,稀释促进电离。所以在稀释过程中,OH-和NH4+的物质的量是增加的,但它们的浓度是降低的。氨水的浓度也降低,但其物质的量也是降低的,所以答案选D。
点评:电离平衡也是一种动态平衡,适用于勒夏特列原理,据此可以进行有关的判断。其次还需要注意物质的量的变化和浓度的变化不一定都是一致的,需要灵活运用。
本题难度:一般
3、选择题 物质的量浓度相同的下列溶液:HCl、H2SO4、CH3COOH,导电能力由强到弱的顺序是
[? ]
A.HCl=H2SO4>CH3COOH
B.H2SO4>HCl>CH3COOH
C.HCl>H2SO4>CH3COOH
D.HCl=H2SO4=CH3COOH
参考答案:B
本题解析:
本题难度:一般
4、填空题 ( 10分)下列物质:①NaCl固体②无水乙醇③稀硫酸④BaSO4固体⑤冰醋酸⑥H2⑦CO2⑧熔融的KOH(选序号填空)
(1)能导电:_____________(2)非电解质:_____________________
(3)强电解质:_____________(4)弱电解质:____________________
(5)已知25℃时两种酸的电离常数:
Ka(CH3COOH)=1.75×10-5, Ka(HClO)=3.0×10-8
判断该反应是否能发生,若能,完成反应方程式;若不能,无需。
CH3COOH +? Ca(ClO)2? ——
参考答案:( 10分)(1)③⑧?(2)②⑦?(3)①④⑧?(4)⑤
(5)2CH3COOH +? Ca(ClO)2= (CH3COO)2 Ca + 2HClO
本题解析:(1)电解质导电必须有自由运动的阴阳离子,所以能导电的是③⑧。
(2)溶于水和在熔融状态下均不能导电的化合物是非电解质,所以答案是②⑦。
(3)在溶液中完全电离,不存在电离平衡的是强电解质,所以答案选①④⑧ 。
(4)在溶液中没有完全电离,存在电离平衡的是弱电解质,所以答案选⑤。
(5)电离常数越大,电离程度越大,所以根据电离常数可知,醋酸的酸性强于次氯酸的,因此根据较强的酸制取较弱的酸可知,反应可以发生,方程式为2CH3COOH +? Ca(ClO)2= (CH3COO)2 Ca + 2HClO。
本题难度:一般
5、选择题 在H2O+CH3COO-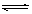 ?CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
?CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是

A.加入NaOH固体
B.加入冰醋酸
C.增大压强
D.升高温度
参考答案:D
本题解析:根据水解方程式可知,溶液显碱性,所以加入氢氧化钠固体,抑制水解;题意加入冰醋酸也是抑制水解;增大压强,不影响水解平衡;水解是吸热的,所以升高温度促进水解,答案选D。
点评:固体是基础性试题的考查,试题注重基础,侧重能力的培养,有利于提高学生分析问题、解决问题的能力。该题的关键是明确水解平衡也是一种动态平衡,适用于勒夏特例原理。
本题难度:一般