1、填空题 (1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g)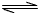 2NH3(g)的△H=_____________。
2NH3(g)的△H=_____________。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:①求5min内的平均反应速率v(NH3)_____________;②达到平衡时NH3的体积分数为_____________。
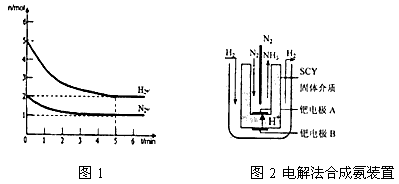
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是______________________________________。
参考答案:(1)-92.4kJ·mol-1
(2)①0.04mol·L-1·min-1②40%
(3)N2+6e-+6H+=2NH3
本题解析:
本题难度:一般
2、填空题 (8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol?L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
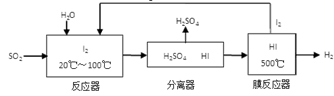
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。
参考答案:(8分)
(1)pH="4" 。(2分)
(2)N2(g)+O2(g)= 2NO(g) △H=+184kJ/mol (2分)
(3)SO2 + I2 + 2H2O = SO42- + 2I- + 4H+(2分) ; H2-2e-+2OH-=2H2O (2分)
本题解析:(1)根据电荷守恒规律,则PM2.5样本中氢离子的浓度是(2×4×10-5+3×10-5+2×10-5)-(2×10-5+4×10-6+6×10-6)=1×10-4mol/L,则pH=4;
(2)根据反应热=断键吸收的能量-成键时放出的能量,则N2和O2反应生成NO的反应热为(946+498)kJ/mol -2×630kJ/mol="+184" kJ/mol,则N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)= 2NO(g) △H=+184kJ/mol;
(3)反应器中发生的反应是二氧化硫与碘水的反应,生成硫酸和HI,离子方程式是SO2 + I2 + 2H2O = SO42- + 2I- + 4H+;氢氧燃料电池中,氢气在负极发生氧化反应,电解质溶液为KOH溶液,则负极是氢气失去电子与氢氧根离子结合为水,电极反应式为H2-2e-+2OH-=2H2O。
考点:考查电荷守恒规律的应用,反应热的计算,热化学方程式的书写,电化学反应原理的应用
本题难度:困难
3、选择题 “暖宝宝”的主要原料有:铁粉、活性炭、水、食盐等。其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液。下列有关“暖宝宝”的说法中错误的是
[? ]
A.活性炭作用是作原电池的正极,加速铁粉的氧化
B.“暖宝宝”放出的热量是铁氧化时产生的
C.“暖宝宝”使用前要密封保存,使之与空气隔绝
D.活性炭最终将转化为二氧化碳
参考答案:D
本题解析:
本题难度:简单
4、填空题 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-―→2O2-)。

(1)c电极的名称为?,d电极上的电极反应式为?。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为?,若a电极产生56 mL(标准状况)气体,则所得溶液的pH=?(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入?(填序号)。
a.CuO?b.Cu(OH)2
c.CuCO3?d.Cu2(OH)2CO3
参考答案:(1)正极 CH4+4O2--8e-=CO2↑+2H2O
(2)4OH--4e-=2H2O+O2↑ 1 ac
本题解析:(1)原电池中电流的方向是从正极流向负极,故c电极为正极;d电极为负极,通入的气体为甲烷,d电极反应式为:CH4+4O2--8e-=CO2+2H2O。
(2)用惰性电极电解CuSO4溶液时,阳极(a电极)反应式:4OH--4e-=2H2O+O2↑;阴极反应式:2Cu2++4e-=2Cu,
n(O2)= =2.5×10-3mol。
=2.5×10-3mol。
线路中转移电子的物质的量为2.5×10-3 mol×4=0.01 mol,溶液中c(H+)= =0.1 mol/L,
=0.1 mol/L,
pH=-lg 0.1=1。加入CuO或CuCO3与溶液中的H+反应,可使电解质溶液恢复到电解前的状态。
本题难度:一般
5、填空题 Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
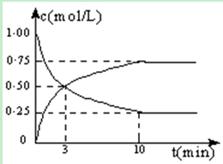
(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:
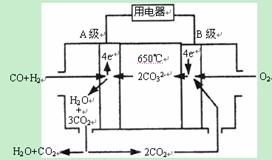
(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
参考答案:
Ⅰ.(1) 90% , K=" 144" , a (2) c d
II.(1) CO+H2-4e-+2CO32-=3CO2+H2O (2) 0.1mol
本题解析:Ⅰ.由图像判断CO2的浓度降低,CH3OH(g)的浓度增高; 容器的体积为2L
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
始量 2 5 0 0
转化量 1.5 4.5 1.5 1.5
平衡量 0.5 0.5 1.5 1.5
H2的转化率为4.5÷5=0.9
K=1.5/2×1.5/2÷(0.5/2 ×(0.5/2)3)=144
Qc=0.80×0.80÷(1.00×0.403)=10<144,故平衡正向移动。
(2)a升高温度平衡逆向移动,比值变小,错误;b恒容下充入He(g),平衡不移动,比值不变,错误;c分离出产物,平衡正向移动,比值变大,正确;d再充入CH3OH(g),其含量变高,比值变大,正确;
II.(1)A电极为负极,注意介质为碳酸盐, CO+H2-4e-+2CO32-=3CO2+H2O ;
(2)电解CuSO4 溶液,阳极产生氧气,阴极首先产生铜单质,后产生氢气,反应式为
阳极:4OH- + 4e- = O2↑+ 2H2O
阴极:Cu2+ + 2e- = Cu(先)
2H+ + 2e- = H2↑(后)
两极产生气体的量相等,根据电子守恒列式为4n-2n=0.1×2[阳极产生的H+ 减去阴极消耗的H+ 等于溶液中剩余H+ ] n=0.1mol
考点:考查化学平衡及电化学有关问题。
本题难度:困难