1、填空题 甲醇是重要的化工原料,在日常生活中有着广泛的应用。 ?
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2?(g)? CH3OH(g)?△H1
CH3OH(g)?△H1
反应Ⅱ:CO2(g)+3H2?(g) ?CH3OH(g)+H2O(g)?△H2
?CH3OH(g)+H2O(g)?△H2
在以上制备甲醇的两个反应中,反应I优于反应Ⅱ,原因为____________
下表所列数据是反应I在不同温度下的化学平衡常数的数值:?

①在一密闭容器中发生反应工并达到平衡后,保持其他条件不变,对容器升温,此反应的化学平衡应____(填“正向”“逆向”或“不”)移动。
②某温度下,将1?mol?CO和4mol?H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1?mol/L,则CO的转化率为____,此时的温度____(填“>”“<”或 “=”)250℃。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+ 4H2O(l)?△H1=-Q1?kJ/mol
②2CO(g)+O2(g)=2CO2(g)?△H2=-Q2?kJ/mol
③H2O(g)=H2O(l)?△H3=-Q3?kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_____________。
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将_____________(填“升高” “降低”或“不变”),该燃料电池负极反应的离子方程式为_____________。

参考答案:(1)反应I符合,即原子利用率为100% ;①逆向 ;②80%?;<
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(g)?△H=(2Q3+0.5Q2 -0. 5Q1)kJ/mol
(3)降低?;CH3OH-6e-+8OH-=CO32- +6H2O
本题解析:
本题难度:一般
2、填空题 (5)现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C。根绝上述情况,回答下列问题:
(1)在①中,金属片 发生氧化反应
(2)在②中,金属片 作负极
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片 上有气泡产生
(4)上述四种金属的活动顺序是
参考答案:.(1) B (2)C (3)D (4)B>A>C>D
(3)PbSO4+2e-=Pb+SO42-;PbSO4+2H2O-2e-= PbO2+4H++ SO42-
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。
(1)把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生,说明A是正极,B是负极,所以金属B发生氧化反应,因此金属性是B大于A。
(2)把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应,说明D是正极,C是负极,所以金属性是C大于D。
(3)A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C,所以金属性是A大于C,所以金属性强弱顺序为B>A>C>D。因此如果把B、D用导线连接后同时浸入稀硫酸溶液,则B是负极,D是正极,溶液中的氢离子在正极得到电子,生成氢气。
本题难度:一般
3、选择题 一种充电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原
B.Ni(OH)2的还原
C.H2的氧化
D.Ni(OH)2的氧化
参考答案:充电池放电时发生NiO(OH)+H2O+e-=Ni(OH)2+OH-,应为原电池的正极反应,NiO(OH)是氧化剂被还原,则充电时NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,则Ni(OH)2被氧化,
故选D.
本题解析:
本题难度:简单
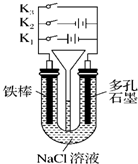
4、选择题 按如图所示装置进行下列不同的操作,其中不正确的是( )
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降