1、选择题 含有下列离子的溶液中分别加入Na2O2固体,不能引起该离子浓度明显变化(不必考虑溶液体积变化)的是( )
A.Clˉ
B.SO32ˉ
C.HCO3ˉ
D.Al3+
参考答案:A
本题解析:考查过氧化钠的性质。过氧化钠溶于水显解析,所以C和D中的离子浓度会减小。但同时过氧化钠还具有强氧化性,能氧化SO32ˉ?生成SO42ˉ,所以正确的答案是A。
本题难度:简单
2、填空题 (16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
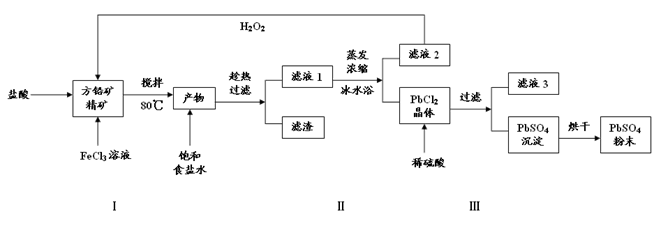
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq)?△H>0
PbCl4-(aq)?△H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式?,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是?。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因?。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式?。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因?,滤液3是?。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的? PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为?。
参考答案:(16分)
(1)PbS+2Fe3++2Cl-= PbCl2+2Fe2++S(3分),抑制Fe3+、Pb2+的水解(2 分)
(2)用冰水浴使反应PbCl2(s)+2Cl-(aq) PbCl4-(aq)逆向移动,使PbCl4?-不断转化为PbCl2晶体而析出。(3分)
PbCl4-(aq)逆向移动,使PbCl4?-不断转化为PbCl2晶体而析出。(3分)
(3)PbCl2(s)+SO42-(aq) PbSO4 (s)?+2Cl-(aq) (2分)
PbSO4 (s)?+2Cl-(aq) (2分)
(4)2Fe2++ H2O2+2H+=2Fe3++2H2O(2分),盐酸(2分)
(5)PbSO4+2e-="Pb+" SO42-(2分)
本题解析:(1)步骤Ⅰ中生成PbCl2和S,说明加入的盐酸、氯化铁与PbS发生氧化还原反应,S元素化合价升高,则铁元素的化合价降低,离子方程式为PbS+2Fe3++2Cl-= PbCl2+2Fe2++S;Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04,所以加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是抑制Fe3+、Pb2+的水解;
(2)加入饱和食盐水后存在PbCl2(s)+2Cl-(aq) PbCl4-(aq)?△H>0,在冰水浴中,温度较低,使平衡逆向移动,生成PbCl2晶体而析出;
PbCl4-(aq)?△H>0,在冰水浴中,温度较低,使平衡逆向移动,生成PbCl2晶体而析出;
(3)Ksp(PbSO4)=1.08×10-8< Ksp(PbCl2)=1.6×10-5,根据沉淀的转化,PbCl2晶体转化为PbSO4沉淀是因为PbCl2中加入稀硫酸破坏了氯化铅的溶解平衡,使溶解平衡正向移动生成硫酸铅,离子方程式为PbCl2(s)+SO42-(aq) PbSO4 (s)?+2Cl-(aq);
PbSO4 (s)?+2Cl-(aq);
(4)滤液2的主要成分是氯化亚铁,与过氧化氢反应又生成氯化铁,作氧化剂使用,离子方程式为2Fe2++ H2O2+2H+=2Fe3++2H2O;由(3)可知氯化铅转化为硫酸铅同时生成氯化氢,所以滤液3是盐酸溶液;
(5)充电时是把电能转化为化学能,相当于电解池装置,所以阴极发生还原反应,Pb的化合价降低成为单质Pb,电极反应式为PbSO4+2e-="Pb+" SO42-
本题难度:一般
3、选择题 向Ba(OH)2溶液中逐滴滴入稀硫酸,下列溶液的导电能力描述正确的是(? )
A.开始时导电能力肯定最强
B.当沉淀为最大值时,导电性最弱
C.先变强,后变弱
D.逐渐变弱
参考答案:B
本题解析:向Ba(OH)2溶液中逐滴滴入稀硫酸,则溶液的导电能力应该是先变弱,再增强,如果硫酸的浓度大于Ba(OH)2溶液的浓度,最终溶液中离子的浓度可能比开始时的浓度大,所以A、C、D错误;当二者恰好完全反应时,此时沉淀量达到最大值,溶液呈中性,溶液离子浓度最小,导电性最弱,B正确。
本题难度:简单
4、选择题 分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是
[? ]
A.H2SO4是酸,因为H2SO4中含有氢元素
B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C.Na和H2O的反应不是离子反应,因为反应中没有离子参加
D.Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列无色溶液中的离子能大量共存的是
A.K+、Na+、MnO4-、SO42-
B.H+、Al3+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、Br-
D.Cu2+、Fe3+、NO3-、Cl-
参考答案:C
本题解析:分析:A、MnO4-是紫色,不能存在.
B、H+与HCO3-发生复分解反应,Al3+与HCO3-发生彻底双水解反应.
C、溶液无色,不发生反应,可以大量共存.
D、Cu2+、Fe3+有颜色,不能存在.
解答:A、MnO4-是紫色,不能存在,故A错误;
B、H+与HCO3-发生反应二氧化碳与水,Al3+与HCO3-发生水解反应生成氢氧化铝沉淀与二氧化碳、水,不能大量共存,故B错误;
C、溶液无色,离子之间不发生反应,可以大量共存,故C正确;
D、Cu2+为蓝色,Fe3+为黄色,不能存在,故D错误.
故选:C.
点评:考查离子共存的判断,难度中等,是对元素化合物知识的综合考查,注意中学常见有颜色的离子、常见能发生双水解反应的离子、发生络合反应的离子以及题目的隐含条件.
本题难度:简单