1、简答题 工业上制取三氧化硫反应的热化学方程式为:2SO2(g)十O2(g)?2SO3(g)△H=-198kJ?mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是______(填序号).
A.每生成1molSO3的同时生成0.5molO2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示.下列叙述正确的是______(填序号).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1?L.在400℃时,容积为1.0L的密闭容器中充入0.05molSO2(g)和0.03molO2(g),反应一段时间后,有0.04molSO3生成.此时,该反应______(填“是”、“否”或“无法判断”)达到化学平衡状态,理由是______.
参考答案:(1)A、每生成1molSO3的同时生成0.5molO2,说明正逆反应速率相等,反应达到平衡状态,故A正确;
B、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故B错误;
C、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;
D、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故D正确;
故选:AD;
(2)A.反应物浓度越大,反应速率越快,故a点时刻的正反应速率比b点时刻的大,故A正确;
B.a、b、c三点未到达平衡状态,反应向正反应进行,故B错误;
C.d、e两点处于平衡状态,温度相同,C(O2)相等,n(O2)相同,故C正确;
D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡时三氧化硫的物质的量减小,故D错误;
故答案为:AC;
(3)2SO2(g)十O2(g)?2SO3
起始(mol/L) 0.050.03 0
反应(mol/L) 0.040.020.04
一段时间后(mol/L)0.01 0.01 0.04
400℃时,浓度熵Q=0.0420.012×0.01=1600>K(400℃)=7200,反应没有达到平衡,故答案:否,400℃时,浓度熵Q=1600,而K(400℃)=7200,Q<K,反应没有达到平衡状态;
本题解析:
本题难度:简单
2、填空题 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式?,该反应的熵变⊿S?0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
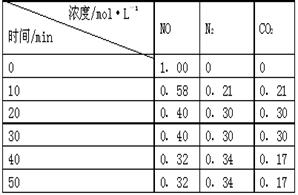
①10min~20min以V(CO2) 表示的反应速率为 ?。
②该反应的平衡常数的表达式为:K=?,根据表中数据,计算T1℃时该反应的平衡常数为? ?(保留两位小数)。
③下列各项能作为判断该反应达到平衡的是?(填序号字母)。
a.容器内压强保持不变 ? b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变? d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是?。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率?(填“增大”、“不变”或“减小”) 。
参考答案:(13分)(1)①CH4(g)+2NO2(g) =N2(g) + CO2(g) +2H2O(l);⊿H=" -955" kJ·mol-1(2分),<(1分)
(2 ) ① 0.009 mol·L-1·min-1(1分,没写单位不得分)
②K=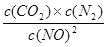 , (1分) K=0.56 (2分)
, (1分) K=0.56 (2分)
③c、d?(2分,写对一个得1分,多些、错写不给分)
④减小 CO2的浓度?(2分)?⑤不变 ??(2分)
本题解析:(1)根据盖斯定律可知,(①+②-③×4)÷2即得到CH4(g)+2NO2(g) =N2(g) + CO2(g) +2H2O(l),所以该反应的反应热△H=(-574 kJ/mol-1160 kJ/mol+44.0 kJ/mol×4)÷2=-955 kJ/mol。根据反应式可知,该反应是体积减小的可逆反应,所以该反应的熵变⊿S<0。
(2)①10min~20min内,CO2的浓度增加了0.30mol/L-0.21mol/L=0.09mol/L,所以以V(CO2)表示的反应速率为0.09mol/L÷10min=0.009mol/(L·min)。
②反应进行到40min时,各种物质的浓度不再发生变化,说明反应已经达到平衡状态,则该反应的平衡常数K=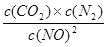 =
=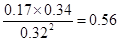 。
。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项c正确;根据方程式可知,反应前后体积是不变的,所以压强始终是不变的,则a不能说明;b中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,d正确,答案选cd。
④根据表中数据可知,NO和CO2的浓度减少,氮气的浓度增加,这说明改变的条件是减小 CO2的浓度,平衡向正反应方向移动。
⑤由于反应前后体积不变,且反应物只有NO一种气体,所以一定温度下,随着NO的起始浓度增大,但平衡不移动,则NO的平衡转化率不变。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难度较大,侧重对学生能力的培养。试题在注重基础知识巩固,侧重对学生解题方法的指导与训练。有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和效率。
本题难度:一般
3、选择题 一定温度下,在一定容的密闭容器中充入N2和H2发生如下反应:N2+3H2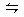 2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将(?)
2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将(?)
A.增大
B.减小
C.不变
D.无法确定
参考答案:A
本题解析:达到平衡后,缩小容器的体积,容器内压强增大,对于反应N2+3H2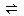 2NH3,平衡向正反应方向移动,则N2的转化率将增大。
2NH3,平衡向正反应方向移动,则N2的转化率将增大。
本题难度:一般
4、选择题 一定条件下,可逆反应2A?

B+3C,在下列四种状态中处于平衡的是( )

A.A
B.B
C.C
D.D
参考答案:化学反应到达平衡时,同一物质的正逆反应速率相等.
A、A物质的正逆反应速率相等,所以该反应达到平衡状态,故A正确.
B、同一反应中,各物质的反应速率之比等于计量数之比,C物质的逆反应速率是2mol/(L.min),A的逆反应速率为43mol/(L.min),A的正反应速率为2mol/(L.min),所以A的正逆反应速率不等,故B错误.
C、同一反应中,各物质的反应速率之比等于计量数之比,B物质的逆反应速率是2 mol/(L.min),A的逆反应速率为4mol/(L.min),A的正反应速率为1mol/(L.min),所以A的正逆反应速率不等,故C错误.
D、同一反应中,各物质的反应速率之比等于计量数之比,C物质的逆反应速率是1.5 mol/(L.min),A的逆反应速率为1mol/(L.min),A的正反应速率为1mol/(L.min),所以A的正逆反应速率相等,故D正确.
故选AD.
本题解析:
本题难度:简单
5、选择题 一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
参考答案:A D
本题解析:依据化学平衡三段式列式计算
2A(g)+B(g)═2C(g)
起始量(mol) 1? 1? 0
变化量(mol)0.6? 0.3? 0.6
平衡量(mol)0.4? 0.7? 0.6
A、以A浓度变化表示的反应速率=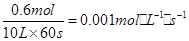 ;故A正确;B、其他条件不变,将容器体积变为5L,C的浓度变为原来的2倍,但反应前后气体体积变化,缩小体积压强增大,平衡正向进行,C的平衡浓度变大于原来的2倍,故B错误;C、其他条件不变,若增大压强,平衡正向进行,则物质A的转化率增大,故C错误;D、达到平衡时,C的体积百分含量=
;故A正确;B、其他条件不变,将容器体积变为5L,C的浓度变为原来的2倍,但反应前后气体体积变化,缩小体积压强增大,平衡正向进行,C的平衡浓度变大于原来的2倍,故B错误;C、其他条件不变,若增大压强,平衡正向进行,则物质A的转化率增大,故C错误;D、达到平衡时,C的体积百分含量=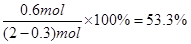 故D正确;故选AD.
故D正确;故选AD.
本题难度:一般