|
|
|
高考化学知识点归纳《盐类水解的原理》高频试题巩固(2019年最新版)(八)
2019-07-04 02:06:59
【 大 中 小】
|
1、选择题 下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O
B.将10mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中,c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+)
D.将10mL 0.1 mol.L-1 KAl(SO4)2溶液和10 mL 0.2 mol.L-1 Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
|
参考答案:C
本题解析:A中前后电荷不守恒;B中将10mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中,反应是Na2CO3+2HCl==2NaCl+H2O+CO2↑,是NaCl和Na2CO3的混合物,故是c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)关系;C中根据电荷守恒是正确的;D中因为Ba(OH)2的物质的量是KAl(SO4)2的2倍,故OH-物质的量是Al3+的4倍,产物是AlO2-,故不正确。
考点:溶液中的离子行为特征判断。
本题难度:一般
2、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
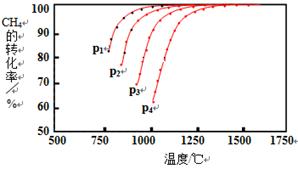
则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
参考答案:Ⅰ.p4>p3>p2>p1;吸热,1024mol2·L-2;
Ⅱ.(1)-867kJ·mol-1;K3=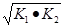
(2)①SO2+2OH-=SO32-+H2O
②c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
10-2mol·L-1
本题解析:I.由图可知,温度降低,转化率下降,则可知该反应为吸热反应,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1; 2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1;
CH4(g)+CO2(g) 2CO(g)+2H2(g) 2CO(g)+2H2(g)
始 5mol 5mol 0 0
转 4mol 4mol 8mol 8mol
平 1mol 1mol 8mol 8mol
平衡浓度:0.5mol/L 0.5mol/L 4mol/L 4mol/L
所以:K= =1024mol2/L2 =1024mol2/L2
II.(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3
那么△H3=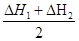 =-867kJ/mol =-867kJ/mol
因△H3=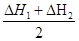 ,那么K3= ,那么K3=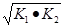
(2)向20mL0.1mol·L-1NaOH溶液通入SO2,由过程中的pH变化曲线可知。a-b段发生的反应是二氧化硫和氢氧化钠反应生成亚硫酸钠,,离子方程式为SO2+2OH-=SO32-+H2O;d点时溶液中溶质为NaHSO3,溶液显酸性,离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);当NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则Ka=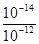 =10-2mol/L。 =10-2mol/L。
考点:反应热的计算,平衡常数的计算,离子方程式的书写,离子浓度大小的比较
本题难度:困难
3、选择题 已知:相同温度下Ka(HF)﹥Ka(HCN)。现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是
A.溶液pH:NaF﹥NaCN
B.n1 ﹥ n2
C.n1﹤ n2
D.c(F-)﹤c(CN-)
参考答案:B
本题解析:NaF溶液中存在Na+? H+? F—? OH—,且F— + OH—?= Na+? + H+?
NaCN溶液中存在Na+? H+? CN—? OH—?,且CN— + OH—?= Na+? + H+
所以只要比较两者溶液中的c(H+)即可比较n1?、n2大小。
越弱越水解,由水解方程式知道:F— +H2O?![]() HF + OH—? CN— +H2O? HF + OH—? CN— +H2O?![]() HCN + OH—,即NaCN水解程度大,溶液的碱性强,c(H+)小,故NaCN溶液中离子浓度小。B正确。 HCN + OH—,即NaCN水解程度大,溶液的碱性强,c(H+)小,故NaCN溶液中离子浓度小。B正确。
本题难度:简单
4、选择题 下列说法中不正确的是
A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<O,则该反应能自发进行
B.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3d.NaOH,则四种溶液中溶质的物质的量浓度由小到大顺序为:d<b<c<a
C.pH=2的一元酸和pH=12的二元强 碱等体积混合:c(OH-)≤c(H+)
D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液中水的电离程度相同
|
参考答案:D
本题解析:A、反应是放热的,熵增的,所以能自发进行,不选A;B、根据越弱越水解的规律,当pH相同时,酸越弱,对应的盐的浓度越小,所以顺序为d<b<c<a,正确,不选B;C、当pH加和等于14的酸碱等体积混合,谁弱显谁性,没有说明酸的强弱,所以混合后可能中性,可能酸性,正确,不选C;D、醋酸钠因为水解,促进水的电离,氨水因为电离抑制水的电离,所以二者溶液中水的电离程度不等,选D。
考点:化学反应进行的方向,溶液的酸碱性的比较,酸碱混合后溶液的性质判断,水的电离的影响因素
本题难度:一般
5、选择题 将下列溶液蒸干、并灼热后,仍能得到原溶质固体的是
A.AlCl3溶液
B.NaAlO2溶液
C.NaHCO3溶液
D.FeSO4溶液
参考答案:B
本题解析:
A、Al3+水解,生成Al(OH)3,同时生成挥发性酸盐酸,最后得到氧化铝固体,故A不合题意;
B、虽然加热时NaAlO2溶液水解生成Al(OH)3,但并未生成挥发性物质,故能得到原物质,符合题意;
C、NaHCO3固体加热时会分解生成碳酸钠,得不到原溶质,故C不合题意;
D、加热时Fe2+水解,硫酸难挥发,但是加热过程中,Fe2+水会被氧化生成Fe2(SO4)3,故不合题意。
考点:盐类的水解的应用
点评:本题考查了盐类的水解,盐溶液的蒸干问题,难度中等。要注意各种物质水解后的产物,以及各物质的特殊性质。
本题难度:一般