1、选择题 不能比较氮和氧非金属性相对强弱的是
A.氨气在氧气中燃烧生成氮气
B.沸点:H2O>NH3
C.NO中N为+2价,氧为-2价
D.热稳定性:H2O>NH3
参考答案:B
本题解析:A非金属性越强对应单质的氧化性越强,氨气在氧气中燃烧生成氮气,说明氧气的氧化性强于氮气,正确。B.中沸点不能说明,只能说明水分子间作用力大于氨分子间,错误。C中NO中N为+2价,氧为-2价 ,说明氧得电子能力强于氮,正确;D中热稳定性:H2O>NH3,能说明,正确;
本题难度:一般
2、选择题 下列各组物质中互为同位素的是( )
A.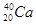 和
和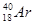
B.D和T
C.H2O和H2O2
D.O3和O2
参考答案:B
本题解析:同位素是指具有相同的质子数而不同质量数的同一元素的不同核素互成为同位素,A中质子数不同,C、D中微粒不是核素,所以正确的答案是B。
本题难度:一般
3、选择题 下列关于物质性质变化的比较,正确的是
A.非金属性强弱: C>Si>P
B.原子半径大小: Na > S > O
C.金属性性强弱: Mg > Na> Li
D.还原性强弱: F- > Cl- > I-
参考答案:B
本题解析:A错,非金属性强弱: C>P>Si;B正确,同周期从左到右原子半径减小,同主族从上到下原子半径增大;C错,金属性性强弱: Na> Mg > Li;D错,还原性强弱: F-< Cl-<I-
本题难度:简单
4、选择题 短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列判断正确的是
A.质子数a>b>c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.元素的金属性:W>X
参考答案:B
本题解析:aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+2=d+1。其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,氢化物的稳定性也是逐渐增强的。非金属性越强,相应阴离子的还原性就越弱,所以只有选项B是正确的,答案选B。
本题难度:简单
5、选择题 同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是
A.原子半径:X>Y>Z
B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:X<Y<Z
参考答案:B
本题解析:同周期元素自左向右,原子序数逐渐增大,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。根据最高价氧化物的水化物的酸性强弱可知,非金属性是X>Y>Z,氢化物的稳定性也是X>Y>Z,原子序数也是X>Y>Z。但原子半径是X<Y<Z,所以只有选项B是正确的,答案选B。
本题难度:一般