1、填空题 (8分)A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
?
| A
| B
| D
| E
|
化合价
| -4
| -2
| -3
| -2
|
电负性
| 2.5
| 2.5
| 3.0
| 3.5
|
(1)基态Fe原子的电子排布式为?。
(2)Fe、Co两元素的第三电离能I3(Fe)?I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为?(填化学式)。
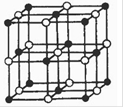
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为?。(用元素符号表示)
(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4-是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。?
①HAD分子中A元素的杂化类型为?,D元素的化合价为?。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式:??。
参考答案:(1)1s22s22p63s23p63d64s2(1分)?(2)<(1分)
(3)H2O>NH3>H2S或H2O、NH3、H2S(1分)?(4)CoO(1分)
(5)① sp (1分)? -3 (1分)
②2[Co(CN)6]4-+2H2O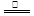 2[Co(CN)6]3-+H2↑+2OH-(2分)
2[Co(CN)6]3-+H2↑+2OH-(2分)
本题解析:(1)根据构造原理可知,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2。
(2)由于亚铁离子失去电子生成铁离子后,3d轨道电子是半充满状态,稳定性强,所以Fe、Co两元素的第三电离能是I3(Fe)>I3(Co)。
(3)根据元素的性质可知,A、B、D、E分别是C、S、N、O。由于水分子和氨气分子间都存在氢键,沸点高,所以气态氢化物的沸点由高到低的顺序为H2O>NH3>H2S。
(4)根据晶胞的结构可知,含有的原子个数分别是12×1/4+1=4、8×1/8+6×1/2=4,所以化学式为CoO.
(5)①HAD分子中氢原子和碳原子形成的单键,氮原子和碳原子形成的是三键,所以是直线型结构,碳原子是sp杂化,氮原子的化合价是-3价。
②[Co(AD)6]4-是一种相当强的还原剂,所以和水反应,水是氧化剂,还原产物是氢气,所以方程式为2[Co(CN)6]4-+2H2O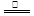 2[Co(CN)6]3-+H2↑+2OH-。
2[Co(CN)6]3-+H2↑+2OH-。
本题难度:一般
2、选择题 下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是
[? ]
A.CO2
B.PCl3
C.CCl4
D.NO2
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列过程中,共价键被破坏的是( )
A.碘升华
B.酒精溶于水
C.冰融化成水
D.HCl气体溶于水
参考答案:D
本题解析:
本题难度:一般
4、填空题 氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为?,氧元素与氟元素能形成OF2分子,该分子的空间构型为?。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为?,1molO22+所含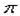 键的数目为?。
键的数目为?。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式?。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:

由此可判断该钙的氧化物的化学式为?。已知晶胞边长为540pm,则该氧化物的密度是?g·cm-3。
参考答案:(1)F ?N? O? V
(2)sp? 2NA
(3)[Ar]3d3或1s22s22p63s23p63d3
(4)CaO2;3.04g/cm3
本题解析:(1)第一电离能由大到小顺序是FNO,由于O中的孤电子对对数=(6-2×1)/2=2,所以OF2分子的空间构型是V形。
(2)NO2+与CO2是等电子体,所以N是sp杂化;O22+离子与N2互为等电子体,1molN2中含有2mol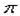 ,故1molO22+所含
,故1molO22+所含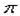 键的数目2NA。
键的数目2NA。
(3)Cr是24号元素,所以Cr3+的核外电子排布式是[Ar]3d3或1s22s22p63s23p6d3
(4)该晶胞结构与NaCl结构相似,所以它的化学式为CaO2,密度=4×72/(NA ×5403×10-30)= 3.04g/cm3。
本题难度:一般
5、简答题 现有A、B、C、D、E五种短周期元素,其中A、B两种元素同主族,A元素原子的最外层电子数是内层电子的数3倍;C是所有元素中原子半径最小的;D的气态氢化物水溶液能使湿润的红色石蕊试纸变蓝;在A、E形成的化合物EA中,A、E离子核外电子数均为10.请按要求回答下列问题:
Ⅰ.(1)写出元素E在元素周期表的位置______;
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是______(填化学式).
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式______;
(2)在一定条件下,将amolC单质和bmolD单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.
参考答案:现有A、B、C、D、E五种短周期元素,A元素原子的最外层电子数是内层电子的数3倍,则A有2个电子层,最外层电子数为6,则A为氧元素;A、B两种元素同主族,则B为硫元素;C是所有元素中原子半径最小的,则C为氢元素;D的气态氢化物水溶液能使湿润的红色石蕊试纸变蓝,则D为氮元素;在A、E形成的化合物EA中,A、E离子核外电子数均为10,则E离子为+2,核外电子数为10,则E为Mg元素,
Ⅰ.(1)E为Mg元素,处于周期表中第三周期第ⅡA族,
故答案为:第三周期第ⅡA族;
(2)非金属性O>N>S,最稳定的氢化物是H2O,
故答案为:H2O;
Ⅱ.元素H、N形成的单质在一定条件下发生反应,该反应是一种重要的化工反应,生成化合物为NH3,
(1)氮气与氢气在高温、高压、催化剂条件下生成氨气,反应化学方程式为:N2+3H2催化剂.高温高压2NH3,
故答案为:N2+3H2催化剂.高温高压2NH3;
(2)在一定条件下,将amolC单质和bmolD单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①N2+3H2催化剂.高温高压2NH3;
开始(mol):b a 0
变化(mol):3 9 6
20min(mol):b-3 116
所以a-9=11,解的a=20
答;a的值为20.
②v(NH3)=6mol20L20min=0.015mol/(L?min),速率之比等于化学计量数之比,故v(N2)=12v(NH3)=12×0.015mol/(L?min)=0.0075mol/(L?min),
答:用氮气表示的反应速率为0.0075mol/(L?min);
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),物质的量为716.8L22.4L/mol=32mol,其中F的含量(体积分数)为25%,则平衡时F的物质的量=32mol×25%=8mol,
答:平衡时F的物质的量为8mol.
本题解析:
本题难度:一般