1、填空题 (14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
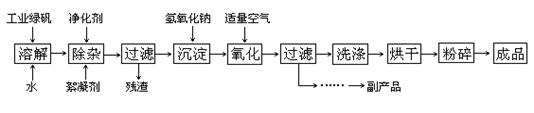
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②? Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O?
③? 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有?;
(2)Fe3O4与稀硝酸反应的离子方程式是?,检验反应后的溶液中含Fe3+的方法?;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:?;
(4)生产中可获得的副产品是?,提取该副产品的操作顺序是?(填写序号)
a.过滤? b.加热浓缩? c.冷却? d.结晶? e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为?L/h(假设反应在标准状态下进行,空气中O2占20%)。
参考答案:(1)FeO、Fe2O3、Fe3O4?(3分)
(2)3Fe3O4 + 28H++NO3-=9Fe3++NO↑+14H2O? (2分)?取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+ (2分)
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3 (2分)
(4)Na2SO4·10H2O(或芒硝,写Na2SO4也可) (1分)?bcdae? (2分)
(5)784 (2分)
本题解析:(1)铁的主要化合价是+2价和+3价,所以常见氧化物是FeO、Fe2O3、Fe3O4。
(2)硝酸具有强氧化性,Fe3O4中含有亚铁离子,所以二者发生氧化还原反应,生成硝酸铁和NO及水。检验铁离子一般用KSCN溶液,现象是溶液显血红色。
(3)氢氧化亚铁具有还原性,极易被氧化生成氢氧化铁。
(4)根据转化示意图和原子守恒可判断,副产物是硫酸钠。要使溶液中的硫酸钠析出,需要加热浓缩,然后利用溶解度随温度的变化通过冷却结晶,即得到硫酸钠晶体,过滤洗涤即可。
(5)要使产品较纯,则氧气和氢氧化亚铁要恰好反应。根据题意可知,每小时通过的硫酸亚铁是42mol。根据Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O可知,氢氧化亚铁和氢氧化铁的物质的量之比是1︰2的,所以需要氧化氢氧化亚铁是28mol,则消耗氧气是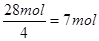 。所以通过的空气是7mol×5×22.4L/mol=784L。
。所以通过的空气是7mol×5×22.4L/mol=784L。
本题难度:一般
2、选择题 核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展,为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁的过程如下:
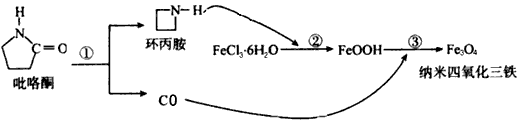
下列有关叙述不合理的是
[? ]
A. 纳米四氧化三铁具有磁性,作为药物载体用于疾病的治疗
B. 纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
C. 在反应②中环丙胺的作用可能是促进氯化铁水解
D. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
参考答案:B
本题解析:
本题难度:一般
3、选择题 下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是
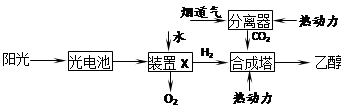
A.该流程图中只存在4种形式的能量转化
B.装置X中阳极反应式为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.本工艺减轻了烟道气中CO2对环境的压力,绿色化学的成分高
参考答案:BD
本题解析:该流程中存在光能转化为电能,电能转化为化学能,化学能转化为内能,3种形式能量转化,A错误;装置X是电解水的装置,阳极反应为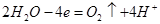 ,B正确;
,B正确;
氢气与二氧化碳反应生成物是乙醇和水,不属于化合反应,C错误;D正确,所以答案选BD。
本题难度:一般
4、选择题 氮的固定是指
A.植物从土壤中吸收含氮养料
B.将空气中的氮气转变为含氮化合物
C.豆科植物根瘤菌将含氮化合物转变为植物蛋白质
D.将氨转变成硝酸及其它氮的化合物
参考答案:B
本题解析:游离态的氮转化为化合态的氮的过程是氮的固定,所以答案选B。
本题难度:简单
5、填空题 钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
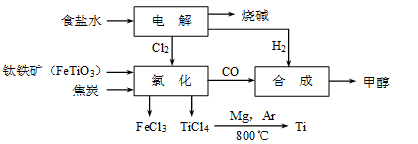
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式?。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:?。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于?℃即可。
?
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,
再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ?mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ?mol。
参考答案:(1)四;IVB(2分)
(2)2FeTiO3+6C+7Cl2 2FeCl3+ 2TiCl4+6CO(2分)
2FeCl3+ 2TiCl4+6CO(2分)
(3)TiCl4+(2+x)H2O TiO2·xH2O+4HCl,加入大量水并加热,氯化氢挥发,使平衡正向移动,促进水解趋于完全(或促使水解正向进行)?(2分)
TiO2·xH2O+4HCl,加入大量水并加热,氯化氢挥发,使平衡正向移动,促进水解趋于完全(或促使水解正向进行)?(2分)
(4)防止钛、镁被氧化(或防止钛镁与空气、水反应)(2分),1412(2分)
(5) (或
(或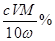 %)(2分)?
%)(2分)?
(6)5(2分)
本题解析:
考点分析:本题需认真解读题给的信息,根据流程图可知(2)中的方程式为2FeTiO3+6C+7Cl2 2FeCl3+
2FeCl3+
2TiCl4+6CO,同样(3)也需要根据提示利用化学平衡的移动原理解题;(4)中结合各种物质的熔沸点确定温度略高于14120C可将Ti分离,而(5)中则利用氧化还原反应利用Ti3+――Ti4+
Fe3+――Fe2+,消耗的NH4Fe(SO4)2的物质的量为c V/1000,所以Ti的物质的量也为c V/1000,TiO2的质量为c VM/1000,其质量分数为c VM/1000w,(6) 结合方程式2FeTiO3+6C+7Cl2 2FeCl3+ 2TiCl4+6CO,生成6molCO同时食盐水电解生成7molCl2,而产生的H2也为7mol,由方程式
2FeCl3+ 2TiCl4+6CO,生成6molCO同时食盐水电解生成7molCl2,而产生的H2也为7mol,由方程式
CO(g)+2H2(g)  CH3OH(g),可知还需要5molH2。
CH3OH(g),可知还需要5molH2。
本题难度:困难