1、选择题 把金属A放入盐B(NO3)2的溶液中,发生如下反应:A+B2+===A2++B,以下叙述正确的是(?)
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A、B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A与B形成的原电池,A一定是正极,B一定是负极
参考答案:C
本题解析:A不正确,既然在溶液中A能置换出B,说明两种金属与水都不反应。酒精是非电解质,不能形成原电池,B不正确。根据方程式可知,A失去电子,所以A是负极,D不正确。因此正确的答案选C。
本题难度:简单
2、选择题 有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.判断它们活动性由强到弱的顺序是
[? ]
A.d、c、a、b
B.d、a、b、c
C.d、b、a、c
D.b、a、d、c
参考答案:B
本题解析:
本题难度:一般
3、选择题 一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷(C2H6)和氧气,有关此电池的推断错误的是
[? ]
A.通乙烷的电极为负极,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O
B.参加反应的O2与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度将下降
D.放电一段时间后,正极区附近溶液的pH减小
参考答案:D
本题解析:
本题难度:一般
4、选择题 如下图所示的两个实验装置,溶液的体积均为200mL。开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液的体积变化,下列叙述中正确的是
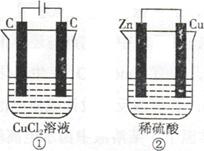
A.产生气体的体积:①>②
B.溶液的pH变化:①减小,②增大
C.电极上生成物质的质量:①=②
D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑
参考答案:B
本题解析:①中阳极发生的反应是2Cl—-2e—=Cl2↑,阴极发生Cu2++ 2e—=Cu,②中Zn极作负极,发生Zn-2e—=Zn2+,Cu极作正极,发生2H++2e—=H2↑,溶质的物质的量均为0.02mol。A、当导线中均通过0.02mol电子时,两装置产生气体体积相等,错误;B、溶液的pH变化:①产生的氯气与水作用使溶液酸性增强,pH减小,②H+浓度减小,使pH增大,正确;C、①产生0.01mol的氯气和0.01mol的铜,②产生0.01mol的氢气,质量不同,错误;D、②中Zn极作负极,发生Zn-2e—=Zn2+,错误,答案选B。
本题难度:一般
5、填空题 (12分)高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
有关物质溶解度与温度的关系如下表:
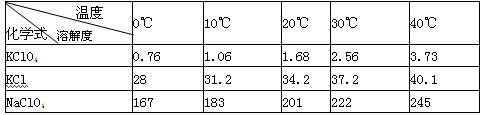
(1)写出实验室制取高氯酸钾的化学方程式: ;用蒸馏水多次洗涤晶体的目的是: 。
(2)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,这类电池称为热电池。Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为: 。
(3)Fe和KClO4作为热电池加热材料的供热原理为:KClO4 (s)+4Fe(s)=" KCl" (s)+ 4FeO(s),△H< 0。
①600℃时FeO可部分分解生成Fe3O4,写成有关的化学方程式: 。
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体。求该加热材料反应前,铁和高氯酸钾的质量。(写出计算过程,结果保留2位有效数字) 。
参考答案:(12分)
(1)NaClO4+ KCl= KClO4↓+NaCl (2分)
尽可能除去溶解度较大的杂质 (2分)
 (2)FeS2 +4Li="Fe" +2Li2S (2分)
(2)FeS2 +4Li="Fe" +2Li2S (2分)
(3)①4FeO====Fe3O4+Fe (2分)
②m(Fe)=n(Fe)×56g·mol-1= 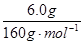 ×2×56g·mol-1=4.2g (2分)
×2×56g·mol-1=4.2g (2分)
m(KClO4)=n(KClO4)×138.5g·mol-1=n(KCl)×138.5g·mol-1=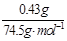 ×138.5g·mol-=0.80g (2分)
×138.5g·mol-=0.80g (2分)
本题解析:(1)KCl、NaClO4溶解,因为KClO4的溶解度较小,所以KClO4以沉淀析出,所以反应的化学方程式为NaClO4+ KCl= KClO4↓+NaCl;因为KCl、NaClO4的溶解度较大,用蒸馏水多次洗涤晶体的目的是尽可能除去溶解度较大的杂质;
(2)Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,所以总反应是FeS2 +4Li="Fe" +2Li2S;
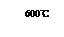 (3)①600℃时FeO可部分分解生成Fe3O4,Fe元素的化合价升高,同时Fe元素的化合价降低,生成Fe单质,则FeO分解的化学方程式为4FeO====Fe3O4+Fe;
(3)①600℃时FeO可部分分解生成Fe3O4,Fe元素的化合价升高,同时Fe元素的化合价降低,生成Fe单质,则FeO分解的化学方程式为4FeO====Fe3O4+Fe;
②根据题意,反应后的混合物为氧化亚铜和氯化钾,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,说明KCl的质量是0.43g;在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体,氧化亚铜与硫酸反应生成硫酸亚铁,再与氢氧化钠反应生成氢氧化亚铁,在空气中氢氧化亚铁转化为氢氧化铁,灼烧后生成氧化铁,该红棕色固体是氧化铁,所以m(Fe)=n(Fe)×56g·mol-1= 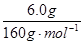 ×2×56g·mol-1=4.2g;m(KClO4)=n(KClO4)×138.5g·mol-1=n(KCl)×138.5g·mol-1=
×2×56g·mol-1=4.2g;m(KClO4)=n(KClO4)×138.5g·mol-1=n(KCl)×138.5g·mol-1=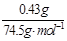 ×138.5g·mol-=0.80g。
×138.5g·mol-=0.80g。
考点:考查对物质制备的分析,化学方程式的书写,物质化学性质的应用,质量计算
本题难度:困难