1、选择题 等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)=2Z(g)+W(s)ΔH<0,下列叙述正确的是(?)
A.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
B.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
C.达到平衡时,反应速率v正(X)=2v逆(Z)
D.平衡常数K值越大,X的转化率越大
参考答案:D
本题解析:A错,该反应正反应方向为放热反应,降低温度,平衡向正反应方向移动,即正反应速率大于逆反应速率,减小倍数更小;B错,升高温度该反应向逆反应方向移动,但增大压强,由于反应为等体积反应平衡不移动;C错,达到平衡时,反应速率2v正(X)=v逆(Z);D正确;
本题难度:一般
2、选择题 难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2 (s)+2I2 (g)  TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)

下列说法正确的是(?)
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
参考答案:C
本题解析:温度可以影响化学平衡的移动,故A项错误。提纯过程中,TaS2是固体,对平衡无影响, B项错误。K= [TaI4]*[S2]/[I2]2,平衡常数与TaI4 和S2 的浓度乘积成正比,D项错误。
本题难度:一般
3、填空题 常温、常压下,可发生如下反应:A(g)+B(g)
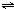
C(g)+nD(g),若将2molA和2molB混合充入体积可变的密闭容器中,在不同条件下达到平衡时,C的浓度如下:
| 温度/℃ | 压强/Pa | C平衡浓度/mol?L-1
25
1×105
1.0
25
2×105
1.8
25
4×105
3.2
25
5×105
6.0
|
(1)可逆反应中,化学计量数n取值范围为______,理由是______.
(2)在5×105Pa时,D的状态为______.
参考答案:解析:(1)根据PV=nRT,温度、物质的量一定时,P1:P2=V2:V1.若P1:P2=1×105 Pa:2×105 Pa=1:2,则对应V2:V1=1:2,即体积变小一半,C的浓度应增大1倍,由1mol?L-1变为2mol?L-1.但是由于平衡移动变成1.8mol?L-1,压强增加到2倍,C的浓度只增加到1.8倍说明平衡向逆反应方向移动,逆反应是气体物质的量减少的反应,故n>1.
故答案为:n>1;压强增加到2倍,C的浓度只增加到1.8倍说明平衡向逆反应方向移动,逆反应是气体物质的量减少的反应,故2<n+1.
(2)将压强由1×105 Pa变为4×105 Pa时,仍符合以上规律.将压强由4×105 Pa变为5×105 Pa时,P1:P2=4:5,C的浓度应为3.2×54=4 mol?L-1.但平衡时,C的浓度增加到6mol?L-1,说明平衡向正反应方向移动.若D为气体,则不可能.只有在A、B、C为气体,D不为气体时,才符合题意,故D为固体或液体.
故答案为:固体或液体
本题解析:
本题难度:一般
4、填空题 (3分)在相同容积的4个容器中进行同一种可逆反应,2A2(g)+ B2(g) 5C(g),起始时4个容器所盛A2和B2的量如下表所示:
5C(g),起始时4个容器所盛A2和B2的量如下表所示:
容量
| 甲
| 乙
| 丙
| 丁
|
A2(mol)
| 2
| 1
| 2
| 1
|
B2(mol)
| 1
| 1
| 2
| 2
|
在相同温度下,建立平衡时,4个容器中A2的转化率由大到小的顺序是?
参考答案:丁>乙>丙>甲
本题解析:根据反应物的物质的量可知,甲相当于是在乙的基础上增加A2的物质的量,所以A2的转化率小于乙中A2的转化率;丙相当于在乙的基础上增大压强,平衡向逆反应方向进行,转化率降低;而丙相当于在丁的基础上增加A2的物质的量,所以A2的转化率小于丁中A2的转化率;丁相当于在乙的基础上增加B2的物质的量,所以A2的转化率大于乙中A2的转化率;又因为丙相当于在甲的基础上增加B2的物质的量,所以A2的转化率大于甲中A2的转化率,则4个容器中A2的转化率由大到小的顺序是丁>乙>丙>甲。
本题难度:一般
5、选择题 对于某反应x+3y=2E+2F在甲、乙、丙、丁四种不同条件下。分别测得反应速率为甲:0.3 mol/(L·min) ;乙:1.2mol/(L·min);丙:0.8mol/(L·min);丁:0.9mol/(L·min),则反应最快的是
[? ]
A.甲
B.乙
C.丙
D.丁
参考答案:D
本题解析:
本题难度:简单