1、填空题 甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
温度/0C
| 250
| 310
| 350
|
K
| 2.041
| 0.250
| 0.012
|
?
(1)由表中数据判断△H? a?0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为?0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
?浓度mol/L
时间/min
| c(CO)
| c(H2)
| c(CH3OH)
|
0
| 0.8
| 1.6
| 0
|
2
| 0.6
| 1.2
| 0.2
|
4
| 0.3
| 0.6
| 0.5
|
6
| 0.3
| 0.6
| 0.5
|
?
①反应从2 min到4 min之间,H2的反应速率为?。
②反应达到平衡时CO的转化率为?。
③反应在第2 min时改变了反应条件,改变的条件可能是?(填序号)。
A.使用催化剂? B.降低温度? C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)? ?CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
?CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1?w2(填序号)。
A.大于?B.小于?C.等于?D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式:?。
参考答案:
Ⅰ(1)<(2分)
(2)310(2分)
(3)①0.3mol/(L·min)(2分,单位写错不得分)?②62.5%(2分,写小数也得分)?③A?(2分)
(4)D(2分)
Ⅱ、2 CH3OH—12 e- +16 OH-=2CO32- + 12 H2O(2分,若“=”写成“→”不扣分,“e-”写成“e”扣1分,其它错误不得分)
本题解析:(1)温度升高,K值减小,平衡向左移动,负反应吸热,故正反应放热。
(2)反应结束后,由CO浓度知CO物质的量为1mol。故CO反应量为1mol,剩余CO为1mol,即0.5mol/L,依次推出,H2反应了2mol,剩余H2为4mol,即2mol/L,生成甲醇1mol,即0.5mol/L,此时,反应平衡,K值为0.5/(0.5*2*2)=0.25,为310℃的平衡常数。
(3)①H2物质的量从1.2mol/L,反应成为0.6mol/L,时间经过2分钟,故反应速率为0.3mol/(L*min)
②容积固定,由0.8mol/L,转化到0.3mol/L,转化量为0.5mol/L,转化率为0.5/0.8=0.625
③2~4min内的反应速率大于0~2min 内的反应速率。故排除B,对比CO浓度的变化,排除C。
(4)本题关键是时间。如果时间很短,未充分反应,那么温度高的反应快,CO量少。但如果充分反应后,温度高的,因为平衡向左移动,CO量较多。故都有可能。
(5)其实是甲醇的燃烧反应与二氧化碳被氢氧化钠吸收的和反应。负极失去电子,C由负二价变为正四价,失去6 个电子,已知右边生成CO32-,由电荷守恒,左边OH-,应为8个,水自然补平。但6不是4(O2吸收电子数)的整数倍,故,整体乘2.
本题难度:一般
2、选择题 对于一定条件下密闭容器中的可逆反应:N2+3H2 2NH3,下列说法正确的是
2NH3,下列说法正确的是
A.升高温度可以降低合成氨的化学反应速率
B.该平衡体系中反应物、生成物一定同时存在
C.加入新型高效催化剂,可以使H2转化率达到100℅
D.该反应若达到平衡时,反应将不再进行
参考答案:B
本题解析:升高温度增大反应速率,A不正确;该反应是可逆反应,反应物的转化率得不到100%,平衡体系中反应物、生成物一定同时存在,因此B正确,C不正确,催化剂不能改变平衡状态;平衡时正逆反应速率相等,但不为0,D不正确,答案选B。
点评:该题是中等难度的试题,试题灵活性强,侧重考查学生对可逆反应以及可逆反应平衡状态的了解、掌握情况,有助于培养学生的逻辑思维能力和抽象思维能力。
本题难度:一般
3、选择题 反应mA(s)+ nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
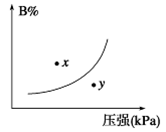
A.n>p
B.x点表示的正反应速率小于逆反应速率
C.x点比y点时的反应速率慢
D.若升高温度,该反应的平衡常数增大
参考答案:C
本题解析:根据图像可知,随着压强的增大,B的含量增大。这说明增大压强平衡逆反应方向进行,所以n小于p,选项A不正确;x点要达到平衡状态,则应该保持压强不变,此时B的含量是减小的,因此反应向正反应方向进行,即正反应速率大于逆反应速率,选项B不正确;y点压强高于x点压强,所以y点反应速率大于x点反应速率,选项C正确;升高温度平衡向逆反应方向进行,平衡常数减小,选项D不正确,答案选C。
本题难度:一般
4、选择题 物质的量之比为2∶3的N2和H2,在一定条件下反应,并达到平衡。在此过程中,下列说法正确的是(?)
A.在建立平衡的过程中,N2和H2的物质的量之比始终是2∶3
B.N2的转化率始终为H2转化率的2倍
C.N2的转化率始终为H2转化率的1/2
D.达到平衡时,平衡体系的总物质的量与起始时的总物质的量之比可为1∶2
参考答案:C
本题解析:设反应的N2物质的量为x。
由? N2 + 3H2 2NH3
2NH3
n(始)?2?3?0
n(变)?x?3x?2x
n(平)?2-x?3-3x?2x
A项应为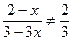 ?(因0<x<1),故不正确;B项应为
?(因0<x<1),故不正确;B项应为 ,故不正确;D项,用反证法,若D成立,则有
,故不正确;D项,用反证法,若D成立,则有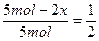 ,解得x=1.25 mol,则3x=3.75mol>3mol,故不可能,则D项不正确。应选C。
,解得x=1.25 mol,则3x=3.75mol>3mol,故不可能,则D项不正确。应选C。
本题难度:一般
5、选择题 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)  xC(g)?△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g)?△H<0。测得两容器中c(A)随时间t的变化如图所示:

容器
| 甲
| 乙
|
容积(L)
| 0.5
| 0.5
|
反应放热(kJ)
| Q1
| Q2
|
反应物起始量
| 1 molA
1 molB
| 0.5 molA
0.5 molB
|
?
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
参考答案:AB
本题解析:根据图表数据可知容器体积为0.5L,当投料量A是1mol时和0.5mol时,达到平衡后前者不是后者的两倍,且平衡时甲中A浓度小于1mol/L。可以说明x不等于2,且气体体积减小,所以x=1,且两者也不是等效平衡。由甲中A的转化量大于一半即转化量多于0.5mol,乙中A的转化量等于50%,即转化了0.25mol,可知放出的热量Q1>2Q2?,B正确。由于两个反应在相同条件下,平衡常数相同,通过三态法可计算出a的值。根据乙在t2时的平衡量关系,求出平衡常数K=2,根据D中数据Q=0.4/0.4*0.4=2.5>2,说明反应向逆向移动,v(正)< v(逆),错误。
本题难度:一般