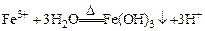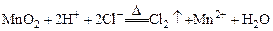|
高中化学知识点讲解《离子方程式的书写及正误判断》试题强化练习(2019年最新版)(二)
2020-07-07 22:52:12
【 大 中 小】
|
1、选择题 下列各反应的离子方程式中,正确的是
A.铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
B.硫酸铝溶液中加入过量的氨水:Al3++3 OH-===Al(OH)3↓
C.铁片放入过量的稀硝酸中:3Fe+8H++ ===3Fe2++2NO↑+4H2O ===3Fe2++2NO↑+4H2O
D.将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O===2Al(OH)4-+3H2↑
|
参考答案:D
本题解析:A、电荷不守恒,错误;B、氨水是弱碱溶液,不能写成氢氧根离子,错误;C、稀硝酸过量时,Fe的氧化产物应是铁离子,错误;D、Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,正确,答案选D。
考点:考查离子方程式书写正误的判断
本题难度:一般
2、填空题 Ⅰ.某化学兴趣小组对下列三组物质进行研究:
A.HCl H2SO4 H2CO3 HNO3
B.溶液 水 悬浊液 胶体
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2
请你帮他们完善下列空白:
| A
| B
| C
| 分类标准
| 含氧酸
| 分散系
|
| 不属于该类别的物质
|
|
| Na2CO3
|
Ⅱ.现有下列物质:①铝 ②氢氧化铁胶体 ③氯化氢 ④SO2 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦稀硫酸 ⑧醋酸 ⑨烧碱 ⑩熔融NaNO3
(1)按物质的分类方法填写表格的空白处:(填编号)
分类标准
| 能导电的物质[
| 电解质
| 强电解质
| 属于该类的物质
|
|
|
|
(2)①与⑨的溶液反应的离子方程式为
(3)用Fe(OH)3胶体进行下列实验:
(a)将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附的颜色逐渐变 (填“深”或“浅”),这表明 。
(b)向其中逐滴加入过量稀硫酸溶液,现象是_______ _______;
(4)向Ba(OH)2溶液逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出此步的离子方程式 。
参考答案:HCl(1分); 水(1分); 硝酸盐(1分);
(1)(每题有多个并列的答案,有错就不给分)
?(1分); ?(1分); ?(1分);
(2)2Al+2OH¯+2H2O=2AlO2¯+3H2↑(2分);
(3)?深(1分); 氢氧化铁胶粒带正电荷(1分);
?先产生红褐色沉淀(1分),后沉淀逐渐溶解,最终溶液呈黄色(1分);(本题全对得2分)
(4)Ba2++OHˉ+H++SO42ˉ=BaSO4↓+H2O(2分);
本题解析: Ⅰ、HCl是无氧酸; 水是纯净物; 除了碳酸钠都是硝酸盐;
Ⅱ.(1)?; ?; ?;
(2)2Al+2OH¯+2H2O=2AlO2¯+3H2↑;
①Fe(OH)3胶粒带正电,通电时带正电荷的粒子向阴极移动,阴极附的颜色逐渐变深;
②向胶体中加入少量电解质溶液时,电解质电离生成的阴离子SO42-中和了 Fe(OH)3胶粒所带的正电荷,使胶粒聚集成较大的颗粒而形成红褐色沉淀,随着硫酸的加入,H+与Fe(OH)3发生反应Fe(OH)3+3H+=Fe3++3H2O,使沉淀溶解,故答案为:先出现红褐色沉淀,后沉淀溶解为黄色溶液;电解质使Fe(OH)3胶体聚沉,随着硫酸的加入,H+与Fe(OH)3发生反应Fe(OH)3+3H+=Fe3++3H2O,使沉淀溶解;
(4)Ba2++OHˉ+H++SO42ˉ=BaSO4↓+H2O。
考点:胶体的重要性质
本题难度:一般
3、填空题 (15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
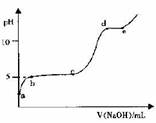
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
参考答案:(1) 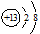 (2)a、c、d (3)CO、CO2 (2)a、c、d (3)CO、CO2
(4)2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1
(5)①Al3++3H2O Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28 Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
本题解析:(1)铝是13号元素,最外层有3个电子,在化学反应中失去3个电子形成铝离子,铝离子的原子结构示意图是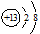
(2) 元素金属性强弱判断依据为看金属与酸或水反应的剧烈程度,反应速率越快,越剧烈,金属性越强,a.分别将Na和Al同时放人冷水中,钠与水剧烈反应,铝几乎不反应,说明钠的金属性强于铝,正确;b.测定等物质的量的Na和A1与酸反应生成H2的体积,与钠、铝失电子数有关,与金属性强弱无关,错误;Al(OH)3能溶于NaOH,说明Al(OH)3是弱碱,NaOH是强碱,所以钠的金属性强于铝,正确;d.用pH计测量NaCl溶液与AlC13溶液的pH,NaCl溶液的PH=7,是强酸强碱盐,AlCl3溶液的PH<7属于强酸弱碱盐,说明Na的金属性强于铝,正确;选a、c、d。
(3)根据化学反应2Al2O3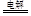 4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。 4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2,化学方程式为2Al2O3+6C=Al4C3+3CO2,转移电子12e-,已知该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1。
(5)①a点是硫酸铝溶液,属于强酸弱碱盐,铝离子水解导致溶液呈酸性,用离子方程式表示为Al3++3H2O Al(OH)3 +3H+, Al(OH)3 +3H+,
②在c→d段pH逐渐增大,说明沉淀逐渐溶解,到达d点,Al(OH)3沉淀已完全溶解,所以c→d时,A1元素的主要存在形式是Al(OH)3。
③向硫酸铝溶液中加入NaOH,当PH=5时开始出现Al(OH)3沉淀,说明此时建立了沉淀溶液平衡,OH-的浓度为10-9mol/L假如,铝离子浓度不变,为0.4mol/L,则A1(OH)3的KSP ≈0.4×[10(-9)]3=4×10-28。
考点:考查铝及其化合物的性质。
本题难度:困难
4、选择题 下列离子方程式正确的是( )
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.硫酸铜溶液与氢氧化钡溶液反应 :Ba2++ SO42
|