1、选择题 下列实验操作或说法错误的是
A.蒸发时,蒸发皿中固体不能蒸干才停止加热
B.蒸馏时,温度计水银球应靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
参考答案:D
本题解析:A、蒸发时,蒸发皿中固体不能蒸干才停止加热,当出现大量晶体时即可停止加热,利用余热蒸干,A正确;B、蒸馏时温度计测量的是气体温度,因此蒸馏时,温度计水银球应靠近蒸馏烧瓶的支管口处,B正确;C、为防止试剂污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,C正确;D、焰色反应时,用稀盐酸洗净铂丝,并在火焰上灼烧至无色,D不正确,答案选D。
本题难度:一般
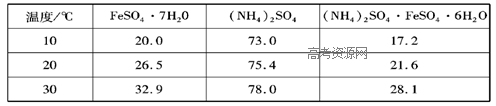
2、实验题 硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
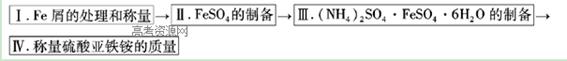
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是?,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)
参考答案:(1)洗涤铁屑表面的油污(1分)?(3) 3.13 (m1-m2)(2分)?
无水乙醇 (1分)?(4) 98%(3分)
本题解析:(1)热的Na2CO3溶液因为水解程度较大,碱性较强,能促进油污的水解而除去。
(3)第(2)步参加反应的铁的质量为(m1-m2)g,物质的量为(m1-m2)/56mol,则生成FeSO4的物质的量为(m1-m2)/56mol,由化学式(NH4)2SO4?FeSO4?6H2O可知,需要(NH4)2SO4的物质的量为(m1-m2)/56mol,设配成饱和溶液需水的质量为mg,根据20℃(NH4)2SO4的溶解度为75.4g列出计算式:?(m1-m2)/56mol×132g/mol:mg=75.4g:100g,解得m=3.13(m1-m2)g;因为硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗,过滤后用无水乙醇洗涤晶体。
(4)根据氧化还原反应电子得失相等可得对应关系:KMnO4—5Fe2+,样品中的(NH4)2SO4·FeSO4·6H2O的质量分数为:0.01mol/L×o.1L×5×4×392g/mol÷1.6g×100%=98%。
本题难度:一般
3、实验题 (10分)用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
(1)所需浓H2SO4的体积为 ?(2分)
?(2分)
(2)如果实验室有10mL、20mL、50mL量筒,应选用?mL量筒,实验中还 需要用到的仪器有?
需要用到的仪器有?
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容?
②定容时俯视刻度线?
(4)若定容时液面高 于刻度线应采取的措施是?
于刻度线应采取的措施是?
参考答案:(10分)
(1)? 13.6ml (2分)
(2)(5分)? 20 mL,?烧杯、玻璃棒、胶头滴管、500ml容量瓶
(3)(3分)①?偏高;②偏高;(4)重新配制
本题解析:略
本题难度:一般
4、选择题 下列有关实验的说法正确的是
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
C.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并搅拌均匀
D.为减小溶液配制误差,容量瓶必须洗净并烘干后才能使用
参考答案:A
本题解析:铝和氢氧化钠反应,但铁和氢氧化钠不反应,A正确。B不正确,10 g ZnSO4·7H2O中硫酸锌的质量不是10g,而是小于10g。C不正确,不应该搅拌。D不正确,容量瓶洗净后没有必要烘干。答案选A。
本题难度:一般
5、填空题  我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
 ①取1.000 kg中草药样品进行灼烧、溶解、过滤等操作制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
①取1.000 kg中草药样品进行灼烧、溶解、过滤等操作制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
 ②将待测溶液转移入250 mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;
②将待测溶液转移入250 mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;
 ③用标准碘溶液滴定待测溶液至终点,消耗20.25 mL标准I2溶液,其间发生反应:
③用标准碘溶液滴定待测溶液至终点,消耗20.25 mL标准I2溶液,其间发生反应:
 H3AsO3+I2+H2O―→H3AsO4+I-+H+(未配平)
H3AsO3+I2+H2O―→H3AsO4+I-+H+(未配平)
 试回答下列问题:
试回答下列问题:
 (1)过滤时需用的玻璃仪器是:?。
(1)过滤时需用的玻璃仪器是:?。
 (2)配平离子反应方程式:[ ]H3AsO3+[ ]I2+[ ]H2O===[ ]H3AsO4+[ ]I-+[ ]H+
(2)配平离子反应方程式:[ ]H3AsO3+[ ]I2+[ ]H2O===[ ]H3AsO4+[ ]I-+[ ]H+
 (3)判断滴定到达终点的现象是:?。
(3)判断滴定到达终点的现象是:?。
 (4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.107 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程:?。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.107 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程:?。
 (5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000 mg/kg,计算可知该样品中砷含量约为 mg/kg,故该中草药样品 (填“合格”或“不合格”)。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000 mg/kg,计算可知该样品中砷含量约为 mg/kg,故该中草药样品 (填“合格”或“不合格”)。
参考答案: (1)漏斗、烧杯、玻璃棒 (3分)(每答对一个给1分)
(1)漏斗、烧杯、玻璃棒 (3分)(每答对一个给1分)
 (2)[1]H3AsO3+[1]I2+[1]H2O===[1]H3AsO4+[2]I-+[2]H+(全对方可给3分)
(2)[1]H3AsO3+[1]I2+[1]H2O===[1]H3AsO4+[2]I-+[2]H+(全对方可给3分)
 (3)溶液由蓝色变为无色,保持半分钟不变色 (3分)
(3)溶液由蓝色变为无色,保持半分钟不变色 (3分)
 (4)IO+5I-+6H+===3I2+3H2O (3分)
(4)IO+5I-+6H+===3I2+3H2O (3分)
 (5)2.278~2.279 (3分) 不合格 (2分)
(5)2.278~2.279 (3分) 不合格 (2分)
本题解析: 运用得失电子守恒法配平化学方程式,H3AsO3+I2+H2O===H3AsO4+2I-+2H+,IO+5I-+6H+===3I2+3H2O,则I2的物质的量浓度为:=0.001 5 mol/L。根据As~H3AsO3~I2,则As的质量为:0.020 255 L×
运用得失电子守恒法配平化学方程式,H3AsO3+I2+H2O===H3AsO4+2I-+2H+,IO+5I-+6H+===3I2+3H2O,则I2的物质的量浓度为:=0.001 5 mol/L。根据As~H3AsO3~I2,则As的质量为:0.020 255 L×
 0.001 5 mol/L×75 g/mol=0.002 278 125 g≈2.278mg,即As的含量为2.278mg/kg,故该中草药样品不合格。
0.001 5 mol/L×75 g/mol=0.002 278 125 g≈2.278mg,即As的含量为2.278mg/kg,故该中草药样品不合格。
 本题考查氧化还原反应滴定实验,中等题。
本题考查氧化还原反应滴定实验,中等题。
本题难度:一般