1、选择题 下列描述违背化学原理的是
[? ]
A.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明酸性:HCO3->Al(OH)3
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
D.在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温度下Ksp(AgI)< Ksp(AgCl)
2、简答题 已知在室温时,Mg(OH)2的溶度积Ksp=5.6×10-12(mol/L)3,要使0.2mol/l MgSO4溶液中的Mg2+沉淀较为完全[c(Mg2+)<5.6×10-6mol/L],则应向溶液中加入NaOH溶液,使溶液的PH最小为多少?
3、填空题 (10分)已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)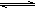 SO2C12(g)
SO2C12(g) 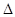 H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
(1)化合物SO2Cl2中S元素的化合价是 。
(2)用二氧化锰和浓盐酸制氯气的化学方程式为 。
(3)用如图所示的装置制备SO2Cl2,下列说法正确是 (选填编号)

a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性碳作催化剂
c.装置C处吸滤瓶应放在冰水中冷却,更有利于SO2Cl的收集
(4)B处反应管冷却水应从 (填“m”或“n”)接口通入,
从化学平衡移动角度分析,反应管通水冷却的目的是 ,D处U形管中盛放的试剂可以是 。
(5)向C中所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子只有SO42—、Cl—(OH—除外),写出SO2Cl2与H2O反应的化学方程式 。
(6)已知室温下,Ksp[AgCl]=2.0×10—10,Ksp[Ag2SO4]=1.6×10—5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,使SO42—和Cl—完全沉淀。当浊液中Ag+浓度为0.1 mol/L时,此浊液中Cl—与SO42—的物质的量浓度之比为 。
4、选择题 从下列事实所得出的结论或给出的解释正确的是
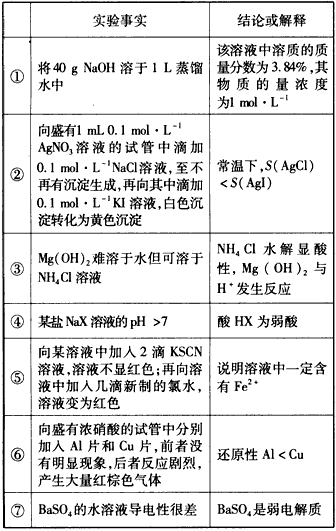
[? ]
A.①⑤⑥
B.④⑤
C.③④⑥⑦
D.③④⑤⑦
5、选择题 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
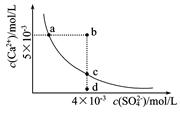
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成
D.向d点溶液中加入适量CaCl2固体可以变到c点