| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《气体的净化、干燥、吸收与收集》试题强化练习(2019年最新版)(二)
______________________________________________________________。 (4)在过程④的操作中发现晶体碘大量附着在烧瓶内壁上,是由于碘具有?性质 参考答案:(每空2分)(1)过滤? Cl2+2I- =2Cl- +I2?(2)B 本题解析:略 本题难度:简单 2、选择题 实验室收集NO和NO2这两种气体的方法正确的是 参考答案:D 本题解析: 本题难度:简单 3、选择题 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图1所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是(?) 参考答案:A 本题解析:能和4种物质发生反应的是Y为K2CO3;能和3种物质发生反应的是BaCl2和FeSO4,;能和2种物质发生反应的H2SO4和氯水,再综合考虑推出可能: 本题难度:简单 4、实验题 (14分) |
参考答案:(14分) I(8分)
(1)关闭F,向A中加入一定量水,打开E,当A中水流下一部分后不再滴下,过一段时间水仍不滴下则甲装置气密性良好。(1分)
(2)① KMnO4;(1分)? I2+5Cl2+6H2O ="=" 2HIO3+10HCl (2分)
②浓硫酸;(1分)? AgNO3+HCl ="==" AgCl↓+HNO3?(1分)
在分液漏斗下接一段橡皮管,然后再在橡皮管下接一毛细管,将毛细管插入B液体中(其它合理答案也给分)(2分)
II(6分)
(1)D;(1分)溶液变蓝色;?(1分)
H2O2+2I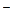 +2H+ ="=" I2+2H2O(2分)
+2H+ ="=" I2+2H2O(2分)
(2) 5H2O2+2MnO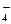 +6H+ ="=" 2Mn2++5O2↑+8H2O(2分)
+6H+ ="=" 2Mn2++5O2↑+8H2O(2分)
本题解析:略
本题难度:一般
5、填空题 (8分)铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:
(1)下列各物质中,不能和单质铝反应的物质是?(填下列各项序号)。
①Fe?②FeCl3?③FeSO4 ?
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,实验得到的分散系
属于?(填“溶液”“浊液”或“胶体”),所得到的分散系中的分散质具有的性质有如下的?(填写序号)。
①电泳?②透过半透膜?③聚沉?④具有强还原性
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:?;证明反应后的溶液中存在Fe3+的实验方法是?。
参考答案:(共8分)?(1) (1分)①? (2) (3分)胶体(1分)①③(2分)
(3) (4分)2FeCl3 + Cu = 2FeCl2 + CuCl2(2分);取试样少许滴入硫氰酸钾溶液,溶液显红色,证明溶液中含有Fe3+(2分)(其它答案合理则同样得分)
本题解析:(1)铝是活泼的金属,且金属性强于铁的,所以铝能和氯化铁,以及氯化亚铁都反应,铁和铝不反应,答案选①。
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,所得到的分散系是胶体,胶体具有电泳现象、能发生聚沉,但氢氧化铁胶体不能透过半透膜、没有强还原性,答案选①③。
(3)氯化铁能和铜反应,生成氯化铜和氯化亚铁,反应的化学方程式是2FeCl3 + Cu = 2FeCl2 + CuCl2。检验铁离子常用试剂是KSCN溶液,即取试样少许滴入硫氰酸钾溶液,溶液显红色,证明溶液中含有Fe3+。
点评:该题是高考中的常见题型,所以注重基础性知识的考查,同时兼顾考查学生分析问题、解决问题的能力。有助于培养学生的逻辑思维能力和发散思维能力,以及严格的规范答题能力。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《反应速率与.. | |