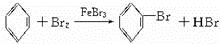
1、实验题 用下面所示的A、B、C三种装置都可制取溴苯.请仔细分析三套装置,然后回答下列问题:
(1)写出三个装置中都发生的反应的化学方程式____________________、____________________;写出B的试管中还发生的反应的化学方程式____________________.
(2)装置A、C中长导管的作用是____________________.
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是__________________,对C应进行的操作是____________________.
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是____________________.
(5)B中采用了双球吸收管,其作用是________________;反应后双球管中可能出现的现象是________________;双球管内液体不能太多,原因是______________________________________________________.
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是________________、________________.
参考答案:(1)2Fe+3Br2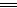 2FeBr3
2FeBr3
HBr+AgNO3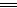 AgBr↓+HNO3
AgBr↓+HNO3
(2)导气(导出HBr)兼冷凝(冷凝 和Br2蒸气)
和Br2蒸气)
(3)旋转分液漏斗活塞,使Br2和苯的混合物滴到铁粉上托起软橡胶袋使Fe粉沿导管落入溴和苯组成的混合液中
(4)Br2和苯的蒸气逸出,污染环境
(5)吸收反应中随HBr气体逸出的Br2和苯蒸气CCl4由无色变橙色易被气体压入试管中
(6)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低?导管插入AgNO3溶液中易产生倒吸
本题解析:在FeBr3的作用下,苯与液溴发生取代反应,生成溴苯和HBr;HBr可用AgNO3和HNO3的混合溶液来鉴定;由于反应放热,溴、苯沸点低,易挥发,所以应该有冷凝装置;由于Br2(g)、苯(g)逸入空气会造成环境污染,所以应该有废气吸收装置。
本题难度:简单
2、填空题 (14分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要?
(2)用?量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
实验次数
| 第一次
| 第二次
| 第三次
|
消耗盐酸溶液体积/mL
| 19.00
| 23.00
| 23.04
|
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛? ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有?_____
A. 配制标准溶液定容时,加水超过刻度? B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。
参考答案:(1)100 mL容量瓶(写容量瓶1分)
(2)碱式滴定管(或移液管); 0.1151 mol·L-1(不写4位有效数字得1分)
(3)注视锥形瓶内溶液颜色的变化
(4)DF (各1分,错选0分)
(5) (6)淀粉溶液;酸式(各1分)
(6)淀粉溶液;酸式(各1分)
本题解析:(1)准确配制一定物质的量浓度的溶液所需要的仪器还缺少100 mL容量瓶。
(2)氢氧化钠是强碱,应该用碱式滴定管。根据数据可知,第一次实验的数据是无效的,所以取后2次的平均值为23.02ml。因此NaOH溶液的浓度为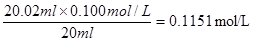
(3)滴定时边滴边摇动锥形瓶,眼睛要始终注视锥形瓶内溶液颜色的变化。
(4)A相当于盐酸的浓度偏低,消耗盐酸的体积就偏大,所以结果偏高。B符合要求,不影响。C也是相当于降低了盐酸的浓度,结果偏高。俯视读出滴定管读数,则读数偏低,则消耗盐酸的体积偏低,测得结果偏低。E中相当于盐酸的体积偏大,结果偏高。F中相当于减少了氢氧化钠的量,消耗盐酸的体积偏低,结果就偏低。
(5)临近终点时pH还会发生突变,如图
(6)碘遇淀粉显蓝色,所以可选择淀粉作指示剂。高锰酸钾溶液具有强氧化性,应该用酸式滴定管。
本题难度:简单
3、填空题 (10分)农村还有些家庭直接用河水或池塘水或井水龙头作为生活饮用水,一般是把水担回家倒入水缸,加明矾使水澄清,加漂白粉进行消毒,煮沸消除暂时硬度,明矾的化学式为?,写出它溶于水后生成胶体的离子方程式:?。漂白粉的成分是?,它在自然条件下能产生次氯酸,次氯酸的氧化性很强,能杀死病菌。写出漂白粉在空气中生成次氯酸的化学方程式:?。煮沸时形成水垢的成份是?(填化学式)
参考答案:KAl(SO4)2·12H2O? Al3++3H2O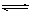 Al(OH)3(胶体)+3H+?
Al(OH)3(胶体)+3H+?
CaCl2、Ca(C1O)2? Ca(C1O)2+CO2+2H2O=CaCO3↓+2HClO
CaCO3、Mg(OH)2
本题解析:明矾的化学式为KAl(SO4)2·12H2O 。明矾溶于后,铝离子水解水生成氢氧化铝胶体,方程式为Al3++3H2O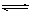 Al(OH)3(胶体)+3H+。漂白粉是混合物,含有CaCl2、Ca(C1O)2。次氯酸钙能吸收空气中的水和CO2,生成次氯酸,方程式为Ca(C1O)2+CO2+2H2O=CaCO3↓+2HClO。水垢的成份是碳酸钙和氢氧化镁。
Al(OH)3(胶体)+3H+。漂白粉是混合物,含有CaCl2、Ca(C1O)2。次氯酸钙能吸收空气中的水和CO2,生成次氯酸,方程式为Ca(C1O)2+CO2+2H2O=CaCO3↓+2HClO。水垢的成份是碳酸钙和氢氧化镁。
本题难度:一般
4、实验题 (10分)
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。
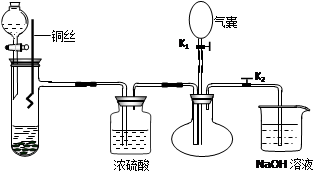
实验步骤:
⑴关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是______________________________________________________,
反应化学方程式是?。
⑵将将铜丝插入稀硝酸中,微热大试管。
该步反应离子方程式是?。
⑶充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中?,证明稀硝酸与铜反应的气体产物是NO。
⑷NaOH溶液的作用?。
参考答案:(1)石灰石与稀硝酸生成C02,把装置中的氧气排尽
(2)CaCO3 +2HNO3 ==Ca(NO3)2 + CO2 + H2O
(3)3Cu + 8 H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O
(4)无色气体变成红棕色气体
(5)尾气处理,以免气体污染环境?(各2分)
本题解析:本题考察了铜与稀硝酸的反应和氮的氧化物的性质。(1)无色NO能够和空气中的氧气反应生成红棕色的NO2,如果需验证反应有一氧化氮生成必须在没有氧气的环境中进行,石灰石的主要成分是碳酸钙,碳酸钙可以和稀硝酸反应生成二氧化碳,排除装置中的空气(氧气)。所以石灰石的作用是:石灰石与稀硝酸生成C02,排尽装置中的氧气,反应的化学方程式为CaCO3 +2HNO3 ==Ca(NO3)2?+ CO2 + H2O (2)铜丝插入稀硝酸中的离子反应为
 3Cu + 8 H+ + 2NO3- = 3Cu2+ + 2NO? + 4H2O(3)充分反应后烧瓶中若有一氧化氮气体,当打开K1,鼓入空气,NO会与氧气反应生成红棕色的二氧化氮气体,所以若烧瓶中气体由无色红棕色说明产生了NO。(4)氮的氧化物属于大气污染物,会导致硝酸型酸雨,所以氮的氧化物不能直接排入空气中,NaOH溶液的作用就是吸收二氧化氮,防止污染环境。
3Cu + 8 H+ + 2NO3- = 3Cu2+ + 2NO? + 4H2O(3)充分反应后烧瓶中若有一氧化氮气体,当打开K1,鼓入空气,NO会与氧气反应生成红棕色的二氧化氮气体,所以若烧瓶中气体由无色红棕色说明产生了NO。(4)氮的氧化物属于大气污染物,会导致硝酸型酸雨,所以氮的氧化物不能直接排入空气中,NaOH溶液的作用就是吸收二氧化氮,防止污染环境。
本题难度:一般
5、选择题 可用下图所示装置制取(必要时可加热)、净化、收集的气体是?
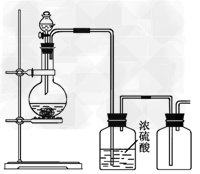
[? ]
A.铜与稀硝酸反应制一氧化氮
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.亚硫酸钠固体与浓硫酸反应制二氧化硫
参考答案:D
本题解析:
本题难度:一般