1、选择题 氢元素位于元素周期表中的第ⅠA族,按其结构与性质,也可以放在第ⅦA族,能支持此种说法的是
A.HCl
B.NaH
C.H2O2
D.H2
参考答案:B
本题解析:ⅦA族元素可呈现—1价,而在NaH中氢元素也呈现—1价,故答案为B
本题难度:困难
2、推断题 A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道;?C元素的基态原子最外层有3个未成对电子,次外层有2个电子;?D?的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:?
(1)C的外围电子排布图为___________?。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为__________;分子的VSEPR模型名称为___________;阴离子的立体构型为______________。
(2)G的价电子排布式为___________。用电子式表示化合物AE2的形成过程________。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为____________和____________(填化学式)。
(4)E有多种含氧酸根①EO-?②EO2-?③EO3-?④EO4-,其中空间构型为四面体型的是__________。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)?
参考答案:(1)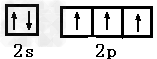 ?;?sp3?;正四面体?;?角型
?;?sp3?;正四面体?;?角型
(2)3d84s2?;“略”
(3)0?;N2?;CN-?
(4)④
(5)CO2、NCl3、CCl4、COCl2、N≡C-C≡N等中的任意2个
本题解析:
本题难度:一般
3、选择题 下列各组物质熔点高低的比较,正确的是
A.Al>Mg>Na
B.MgO>KCl>NaCl
C.晶体硅>金刚石>碳化硅
D.Cl2>Br2> I2
参考答案:A
本题解析:试题分析:A中都是金属晶体,金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高,A正确;B中都是离子晶体,离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高,B不正确,应该是MgO >NaCl>KCl;C中都是原子晶体,熔点大小和共价键的强弱有关系,碳原子半径小于硅原子的比较,所以熔点大小顺序是金刚石>碳化硅>晶体硅,C不正确;D中都是分子晶体,形成分子晶体的分子间作用力越大,熔点越高,分子间作用力和相对分子质量有关系,相对分子质量越大,分子间作用力越大,所以D不正确,应该是I2>Br2>Cl2,答案A。
考点:考查晶体熔点高低的判断
点评:该题是中等难度有的试题,试题综合性强,侧重对学生灵活运用基础知识解决实际问题的能量的培养。该题的关键是准确出物质的晶体类型,然后依据相应晶体类型的判断要求即可,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难
4、选择题 下列性质的递变规律不正确的是
A.HCl、HBr、HI的热稳定性依次减弱
B.Cl-、Br-、I-离子的半径依次减小
C.HCl、HBr、HI的水溶液的酸性依次增强
D.Cl-、Br-、I-离子的还原性依次增强
参考答案:B
本题解析:按F、Cl、Br、I的顺序:原子半径依次增大;离子半径依次增大;氢化物的稳定性依次减弱;氢化物的水溶液的酸性依次增强;最高价含氧酸的酸性依次减弱;其单质的氧化性依次减弱;其离子的还原性依次增强.与备选项比较得B项不正确.
本题难度:一般
5、选择题 下列物质中只含有离子键的是
A.H2O
B.MgCl2
C.NH4Cl
D.C2H5OH
参考答案:B
本题解析:A 只含共价键
B 只含离子键
C 既含离子键,又含共价键
D 只含共价键
故选B
本题难度:困难