1、选择题 高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
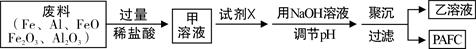
下列判断无法确定的是
A.PAFC因水解而能净水
B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性
D.乙溶液肯定不可能呈强碱性
参考答案:B
本题解析:A、[AlFe(OH)nCl6-n]m可水解生成氢氧化铝和氢氧化铁,具有吸附性,可用于净水,故A不选;B、由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是存在Fe2+还是Fe3+或是二者都有,则加入KSCN溶液后溶液不一定成血红色,故B选;C、加入X应为氧化剂,可将Fe2+生成Fe3+,因.[AlFe(OH)nCl6-n]m中Fe为+3价,可起到净水剂的作用,故C不选;D、如呈强碱性,则不可能生成.[AlFe(OH)nCl6-n]m,因氢氧化铝与氢氧化钠反应生成偏铝酸钠,故D不选。
考点:本题考查物质的制备、化学流程的分析。
本题难度:一般
2、填空题 (1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH:
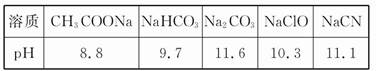
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是 (填编号);其pH为 (填数值);pH最大的是 (填编号)。
①CH3COOH ②HCN ③HClO ④H2SO4 ⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律: ;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式: 。
参考答案:(1)④ 1 ②
本题解析:(1)5种溶液中H2SO4、HClO4为强酸,相同浓度时H2SO4的pH最小,pH=-lg(2×0.05)=1。pH最大的即酸性最弱的,根据“酸越弱越水解”并结合题干信息,相同浓度时NaCN碱性强,则对应的HCN的酸性最弱,pH最大。因CO32-对应酸为HCO3-,此处易将Na2CO3溶液碱性更强误认为H2CO3酸性最弱。
(2)从题给3个转化可以看出,反应之所以能够发生,是因为生成溶解度更小的物质。因AgI的溶解度小于AgCl,白色沉淀AgCl能够转化为黄色沉淀AgI
本题难度:一般
3、填空题 (16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
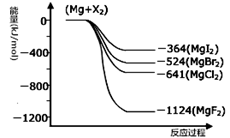
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
参考答案:(16分)
I.(1) 60 %(2分) 2.25(2分)
(2) c、d(2分)
II.(1)
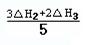 (2分)
(2分)
(2)①O2 + 4e-+ 2H2O  4OH- (2分) ② 2.24 (2分)
4OH- (2分) ② 2.24 (2分)
III.(1)放热 (2分)
(2)2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2或CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓(2分)
本题解析:I.(1)设平衡时CO的浓度减少xmol/L,则
CO(g)+H2O(g)  CO2 (g) +H2(g)
CO2 (g) +H2(g)
开始(mol/L)1/5=0.2 1/5=0.2
转化(mol/L)x x x x
平衡(mol/L)0.2-x 0.2-x x x
根据题意,CO的浓度为0.08 mol·L-1,则0.2-x=0.08,x=0.12,所以CO的转化率是0.12/0.2×100%=60%;
平衡常数K= c(CO2)·c(H2)/c(CO)·c(H2O)=x2/(0.2-x)2=2.25;
(2)a.因为该反应是气体的物质的量不变的可逆反应,则容器内压强始终不随时间改变,不能判断平衡状态,错误;b.因为容器的体积不变,则混合气体的密度始终不随时间改变,不能判断平衡状态,错误; c.单位时间内生成a mol CO2的同时消耗a mol H2,符合正逆反应速率相等,是平衡状态,正确;d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6时,Qc= c(CO2)·c(H2)/c(CO)·c(H2O)= 6×6/1×16=2.25=K,所以是平衡状态,答案选cd;
II.(1)①中无NO气体,根据盖斯定律,将②×3+③×2 消去NO可得5×①,所以①中的△H1=(3△H2+2△H3)/5;
(2)①根据4NH3+3O2=2N2+6H2O,可知正极是氧气发生还原反应,生成氢氧根离子,所以正极的电极反应式为O2 + 4e-+ 2H2O  4OH-;
4OH-;
②9.75gZn的物质的量是9.75g/65g/mol=0.15mol,则失去电子的物质的量是0.15mol×2=0.30mol,根据得失电子守恒,则氧气得到电子的物质的量是0.30mol,则需要氧气的体积是0.30mol/4×22.4L/mol=1.68L,所以氨气的体积是1.68L×4/3=2.24L.
III.(1)由图可知,反应物的总能量大于生成物的总能量,所以反应为放热反应;
(2)CH3MgCl易与水发生水解反应并有无色无味气体和沉淀生成,该沉淀为氢氧化镁沉淀,根据元素守恒,则该气体中含C元素,为甲烷气体,同时还有氯化镁生成,则反应的化学方程式为2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2。
考点:考查化学平衡的判断、计算,电化学反应原理的应用,化学方程式的判断与书写
本题难度:困难
4、选择题 对H2O的电离平衡不产生影响的粒子是( )
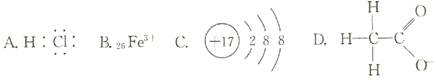
参考答案:C
本题解析:A.HCl溶于水电离产生H+,对水的电离平衡起抑制作用。错误。B.Fe3+在水中发生水解反应:Fe3++3H2O Fe(OH)3(胶体)+3H+;由于消耗了水电离产生的OH-,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡。错误。C.Cl-既不会和H+发生作用,也不会与OH-发生反应,因此对水的电离平衡无影响。正确。D.CH3COO-是弱酸根,会发生水解反应:CH3COO-+H2O
Fe(OH)3(胶体)+3H+;由于消耗了水电离产生的OH-,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡。错误。C.Cl-既不会和H+发生作用,也不会与OH-发生反应,因此对水的电离平衡无影响。正确。D.CH3COO-是弱酸根,会发生水解反应:CH3COO-+H2O CH3COOH+OH-。由于消耗了水电离产生的H+,,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡。错误。
CH3COOH+OH-。由于消耗了水电离产生的H+,,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡。错误。
考点:考查影响水的电离平衡的因素的知识。
本题难度:一般
5、选择题 25℃时,将稀CH3COOH逐滴加入到稀NaOH溶液中,当溶液的pH=7时,下列关系不正确的是
A.c(CH3COO-)+ c(CH3COO-)=c(Na+)
B.c(OH-) = c(H+)
C.c(CH3COO-) +c(H+)= c(Na+) +c(OH-)
D.c(Na +)=c(CH3COO-)
参考答案:A
本题解析:
根据电荷守恒,有c(CH3COO-)+ c(CH3COO-)=c(Na+)+ c(H+), 25℃时,pH=7,则c(OH-) = c(H+)=10-7mol/L,由此可得c(Na +)=c(CH3COO-) ,BCD正确,A错,故选A。
本题难度:简单