|
高考化学必考知识点《物质的量》试题特训(2019年最新版)(四)
2020-07-07 23:00:17
【 大 中 小】
|
1、选择题 在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是(?)
A.ω=35a/(22.4Vρ)
B.c =a/(22.4V)mol/L
C.上述氨水中再加入等体积等浓度的稀盐酸后溶液恰好呈中性
D.上述氨水中再加入V mL水后,所得溶液的质量分数小于0.5ω
参考答案:D
本题解析:A.氨气溶于水,主要以NH3?H2O存在,但仍然以NH3作为溶质, = =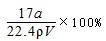 , ,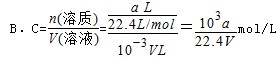 故B错误;C、上述氨水中再加入等体积等浓度的稀盐酸后生成氯化铵,为强酸弱碱盐,溶液呈酸性,故C错误;D. 故B错误;C、上述氨水中再加入等体积等浓度的稀盐酸后生成氯化铵,为强酸弱碱盐,溶液呈酸性,故C错误;D.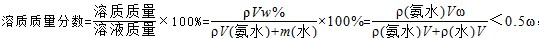 ,故D正确; ,故D正确;
本题难度:一般
2、选择题 下列叙述中正确的是
①标准状况下,lL HCl和lL H2O的物质的量相同
②标准状况下,lg H2和14g N2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体的物质的量越大。则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③
B.②⑤⑥
C.②③⑥
D.④⑤⑥
|
参考答案:B
本题解析:①标准状况下水不是气态,不能适用于气体摩尔体积,则lL HCl和lL H2O的物质的量不相同,错误;②标准状况下,lg H2和14g N2的物质的量均是0.5mol,体积相同,正确;③28gCO的物质的量是1mol,其体积不一定为22.4L,错误;④两种物质的物质的量相同,则它们在标准状况下的体积不一定也相同,因为不一定都是气体,错误;⑤根据PV=nRT可知在同温同体积时,气体的物质的量越大,则压强越大,正确;⑥同温同压下,气体的密度与气体的相对分子质量成正比,正确,答案选B。
考点:考查阿伏加德罗定律的应用
本题难度:一般
3、简答题 实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL:
(1)配制时,必须使用到的玻璃仪器有______、______、______、______
(2)使用容量瓶前必须进行的一步操作是______
(3)要完成本实验该同学应称出NaOH______g
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是______
①称量固体药品时所用的砝码是生锈的
②称量时间过长
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
参考答案:(1)没有480mL容量瓶,所以选择500mL容量瓶,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有托盘天平、烧杯、500ml的容量瓶、胶头滴管、药匙,
故答案为:烧杯;500ml的容量瓶;玻璃棒;胶头滴管;?
(2)因为最后需颠倒摇匀,所以容量瓶在使用前必须检查是否漏水.故答案为:查漏;
(3)需氢氧化钠的质量为m=0.5L×1mol?L-1×40g/mol=20.0g.故答案为:20.0;
(4)①称量固体药品时所用的砝码是生锈的,氢氧化钠的实际质量偏大,溶液浓度偏高,
②称量时间过长,由于氢氧化钠具有吸湿性,氢氧化钠的实际质量偏小,溶液浓度偏低,
③容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
④定容时俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高;
⑤未冷却到室温就将溶液转移到容量瓶并定容,温度恢复室温后,会导致溶液体积偏小,溶液浓度偏高;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
故选:①④⑤.
本题解析:
本题难度:一般
4、选择题 在无土裁培中,配制1L含0.5molNH4Cl、0.16molKCl、0.24molK2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为( )
A.0.40mol0.50mol0.12mol
B.0.66mol0.50mol0.24mol
C.0.64mol0.50mol0.24mol
D.0.64mol0.02mol0.24mol
参考答案:①0.5molNH4Cl、0.16molKCl、0.24molK2SO4中 n(NH4+)=n(NH4Cl)=0.5mol;
n( Cl-)=n(NH4Cl)+n(KCl)=0.5mol+0.16mol=0.66mol;
n( K+)=n(KCl)+2n(K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n(K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,
n((NH4)2SO4)=n(SO42-)=0.24mol;
n(KCl)=n( K+)=0.64mol;
n(NH4Cl)=n( Cl-)-n(KCl)=0.66mol-0.64mol=0.02mol;
答案为:0.64mol;0.02mol;0.24mol;
故选D.
本题解析:
本题难度:简单
5、选择题 当物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液中所含Cl-的个数相等时,这三种溶液的体积比应是( )
A.1:1:1
B.1:2:3
C.3:2:1
D.6:3:2
参考答案:设NaCl、MgCl2、AlCl3三种溶液的物质的量浓度为c,体积分别为x、y、z;所含Cl-的个数相等,所以氯离子的物质的量相等,设氯离子的物质的量为m,
NaCl溶液中,c(NaCl)=c(Cl-),n(Cl- )=cx=m,x=mc,
MgCl2溶液中,c(MgCl2)=12c(Cl-)=c,c(Cl-)=2c,n(Cl- )=2cy=m,y=m2c,
AlCl3溶液中,c(AlCl3)=13c(Cl-),c(Cl-)=3c,n(Cl- )=3cz=m,z=m3c,
NaCl、MgCl2、AlCl3三种溶液的体积比应 mc:m2c:m3c=6:3:2,
故选D.
本题解析:
本题难度:一般
|