|
|
|
高考化学知识点归纳《盐类水解的原理》高频试题特训(2019年最新版)(二)
2020-07-07 23:00:58
【 大 中 小】
|
1、选择题 在蒸发皿中加热蒸干下列物质的溶液,再灼烧可以得到原溶质固体的是
A.AlCl3
B.NaHCO3
C.MgSO4
D.KMnO4
|
参考答案:C
本题解析:A、AlCl3+3H2O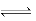 Al(OH)3+3HCl,加热蒸干,HCl易挥发,平衡右移,生成氢氧化铝,再灼烧2Al(OH)3 Al(OH)3+3HCl,加热蒸干,HCl易挥发,平衡右移,生成氢氧化铝,再灼烧2Al(OH)3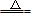 Al2O3+3H2O,最终生成氧化铝,不符合题意;B、加热蒸干溶液,得到碳酸氢钠固体,再灼烧2NaHCO3 Al2O3+3H2O,最终生成氧化铝,不符合题意;B、加热蒸干溶液,得到碳酸氢钠固体,再灼烧2NaHCO3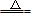 Na2CO3+H2O+CO2↑,最终得到碳酸钠,不符合题意;C、硫酸镁溶液加热蒸干,得到硫酸镁固体,硫酸镁性质稳定,受热不分解,符合题意;D、高锰酸钾溶液加热蒸干,得到高锰酸钾固体,高锰酸钾不稳定受热分解2KMnO4 Na2CO3+H2O+CO2↑,最终得到碳酸钠,不符合题意;C、硫酸镁溶液加热蒸干,得到硫酸镁固体,硫酸镁性质稳定,受热不分解,符合题意;D、高锰酸钾溶液加热蒸干,得到高锰酸钾固体,高锰酸钾不稳定受热分解2KMnO4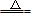 K2MnO4+MnO2+O2↑,不符合题意。 K2MnO4+MnO2+O2↑,不符合题意。
考点:考查盐类水解、元素及其化合物的性质。
本题难度:一般
2、填空题 写出下列盐溶液水解的离子方程。
(1)(NH4)2SO4:____________________;
(2)AlCl3:____________________;
(3)KF:____________________;
(4)Na3PO4:____________________;
参考答案:(1)NH4++H2O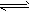 NH3·H2O+H+ NH3·H2O+H+
(2)Al3++3H2O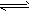 Al(OH)3+3H+ Al(OH)3+3H+
(3)F-+H2O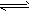 HF+OH- HF+OH-
(4)PO43-+H2O HPO42-+OH-、HPO42-+H2O HPO42-+OH-、HPO42-+H2O H2PO4-+OH-;H2PO4-+H2O H2PO4-+OH-;H2PO4-+H2O H3PO4+OH- H3PO4+OH-
本题解析:
本题难度:一般
3、填空题 (1)下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
K2CO3______,溶液呈______性;
K2SO4______,溶液呈______性;
NH4Cl______,溶液呈______性.
(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH由大到小的顺序为:______(填数字代号)
(3)现有常温下的0.1mol?L-1Na2CO3溶液:
①你认为该溶液呈碱性的原因是(用离子方程式表示)______;
②为证明你的上述观点,请设计一个简单的实验,简述实验过程______.
参考答案:(1)K2CO3是强碱弱酸盐,水解后水溶液都呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,
Na2SO4是强酸强碱盐,不水解,溶液呈中性;
NH4Cl是强酸弱碱盐,水解后溶液呈酸性,水解离子方程式为NH4++H2O?NH3?H2O+H+,
故答案为:CO32-+H2O?HCO3-+OH-;碱;不水解;中性;NH4++H2O?NH3?H2O+H+;酸;
(2)酸:⑤CH3COOH是弱电解质,所以只有部分电离,故c(H+)<0.1mol/L,所以pH>1;
碱:⑥NaOH是强电解质,完全电离,c(OH-)=0.1mol/L,所以pH=13;
⑦Ba(OH)2是强电解质,完全电离,c(OH-)=0.2mol/L,所以pH=13.7;
盐:④NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以c(H+)=0.1mol/L,所以pH=1;
⑧NH4Cl是强酸弱碱盐,水解后溶液呈酸性,1<pH值<7;
①KNO3是强酸强碱盐,水溶液呈中性,pH=7;
②Na2CO3是强碱弱酸盐,水溶液都呈碱性;
③NaHCO3是弱酸的酸式盐水解显碱性,水解程度小于Na2CO3 ,碱性小于Na2CO3,所以pH由大到小的顺序为:⑦>⑥>②>③>①>⑧>⑤>④,
故答案为:⑦>⑥>②>③>①>⑧>⑤>④;
(3)①Na2CO3是强碱弱酸盐,水解后水溶液都呈碱性,其水解离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为;CO32-+H2O?HCO3-+OH-;
②向Na2CO3溶液中加酚酞试液,溶液变红色,说明溶液显碱性,证明Na2CO3水解,
故答案为:向Na2CO3溶液中加酚酞试液,溶液变红色,说明溶液显碱性,证明Na2CO3水解.
本题解析:
本题难度:一般
4、选择题 在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
A.Fe2S3、I2
B.Al(OH)3、I2
C.Fe(OH)3、Al(OH)3
D.FeS、S、Al(OH)3
|
参考答案:D
本题解析:氧化性Fe3+ >Al3+,因此加入过量I-,先和Fe3+反应生成Fe2+和I2,再加入S2-,可以和Al3+发生双水解得到硫单质和氢氧化铝沉淀,所以D选项正确。
考点:考查了溶液中离子的氧化还原反应和双水解反应。
本题难度:一般
5、选择题 已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是
A.NaX NaY NaZ
B.NaX NaZ NaY
C.NaY NaZ NaX
D.NaZ NaY NaX
参考答案:D
本题解析:
试题解析:酸性越弱,相应的钠盐越容易水解,碱性越强,PH越大,故三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是NaZ、NaY、NaX。
考点:盐类水解的规律
本题难度:一般