1、选择题 有K2SO4和Al2(SO4)3的混合液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,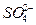 的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为(? )
的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为(? )
A.0.1 mol·L-1
B.0.15 mol·L-1
C.0.2 mol·L-1
D.0.25 mol·L-1
参考答案:C
本题解析:根据电荷守恒有:c(K+)+3c(Al3+)=2c(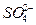 ),则c(K+)=2c(
),则c(K+)=2c(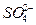 )-3c(Al3+)="2×0.7" mol·L-1-3×0.4 mol·L-1="0.2" mol·L-1。
)-3c(Al3+)="2×0.7" mol·L-1-3×0.4 mol·L-1="0.2" mol·L-1。
本题难度:简单
2、选择题 下图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于
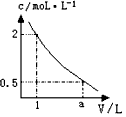
[? ]
A.2
B.3
C.4
D.5
参考答案:C
本题解析:
本题难度:简单
3、计算题 浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下)。已知:
Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。试计算:
CuSO4+SO2↑+2H2O。试计算:
(1)反应中消耗的铜的质量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中CuSO4的物质的量浓度是多少?
参考答案:(1)9.6g (2)0.3mol/L
本题解析:假设消耗铜的质量为m克,则根据方程式列式计算:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
1 22.4
m n 3.36
64/m=22.4/3.36 m=9.6g
1/n=22.4/3.36 n="0.15mol"
硫酸铜的浓度=0.15/0.5=0.3mol/L。
考点:化学方程式的计算,物质的量浓度。
本题难度:一般
4、选择题 在标况下,将O2与NO2按1:4的体积比充满于一真空干燥烧瓶中,然后将烧瓶倒置于水中,瓶中液面逐渐上升后,至几乎完全充满烧瓶,最终烧瓶内溶液的物质的量浓度最接近于
A.0.026mol/L
B.0.030mol/L
C.0.036mol/L
D.0.045mol/L
参考答案:C
本题解析:4NO2+O2+2H2O= 4HNO3
烧瓶体积为v,根据方程式确定生成硝酸的物质的量为4v/5 ÷22.4
最终烧瓶内溶液的物质的量浓度=" 4v/5" ÷22.4÷v=0.036mol/L
本题难度:一般
5、选择题 标准状况下,一个装满氯气(Cl2)的集气瓶质量为74.6 g,若装满氮气,其质量为66 g,则此容器的体积为(?)
A.22.4 L
B.2.24 L
C.44.8 L
D.4.48 L
参考答案:D
本题解析:用差量法分析,当体积为22.4 L时,装Cl2和装N2的两瓶质量差为43 g,设容器容积为x,则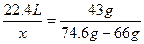 ,所以x="4.48" L。
,所以x="4.48" L。
本题难度:简单