1、选择题 从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.酒精溶解于水
B.冰融化
C.氯化钠受热熔化
D.碳酸氢铵受热产生刺激性气味气体
参考答案:A、酒精属于非电解质,溶于水没有化学键的断裂,故A错误;
B、冰融化属于物理变化,没有化学键的断裂和形成,故B错误;
C、氯化钠晶体受热熔化属于物理过程,只存在旧键的断裂,没有新键生成,故C错误;
D、碳酸氢铵受热分解发生了化学变化,所以既有旧化学键断裂,又有新化学键形成,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 等质量的铝粉与足量盐酸在不同条件下反应,产生H2的体积与反应时间关系如右图所示,则图中曲线a、b、c分别对应表中的实验组别是
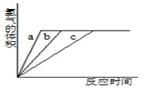
A.①—②—③
B.②—①—③
C.②—③—①
D.③—②—①
参考答案:D
本题解析:试题分析:盐酸的浓度越大,溶液的温度越高,反应速率就越快,反映在曲线上斜率就越大。所以根据表中数据和图像可知曲线a、b、c分别对应表中的实验组别是③—②—①,答案选D。
考点:考查外界条件对反应速率饿影响
点评:该题是中等难度试题的考查,主要是考查学生对影响反应速率外界因素的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难
3、填空题 (6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ/mol,H—H键的键能是436.0 kJ/mol;由N2和H2合成1 mol NH3时可 放出46.2 kJ的热量。则N—H键的键能是_______________________。
放出46.2 kJ的热量。则N—H键的键能是_______________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol?①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol?②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640 .5 kJ/mol?③
.5 kJ/mol?③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式______________________________。
(3)已知两个热化学方程式:
C(s)+O2(g)=CO2 (g)?△H= ― 393.5kJ/mol
(g)?△H= ― 393.5kJ/mol
2H2(g)+O2(g )=2H2O(g)?△H= ― 483.6kJ/mol
)=2H2O(g)?△H= ― 483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是?.
参考答案:(1) 383.85KJ ;(2)略?(3)1:1
本题解析:略
本题难度:一般
4、选择题 在相同条件下,一定量的氢气在氧气中充分燃烧并放出热量。若生成液态水放出的热量为Q1;若生成气态水放出的热量为Q2。那么Q1与Q2之间的大小关系是(?)
A.Q1>Q2
B.Q1<Q2
C.Q1=Q2
D.不能确定
参考答案:A
本题解析:由于一定量的氢气在相同条件下都充分燃烧,且燃烧后都生成水,若都是生成气态水,则Q1=Q2。但事实是氢气燃烧分别生成液态水和气态水,由气态水转化为液态水还要放出热量,故Q1>Q2。
本题难度:一般
5、选择题
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
参考答案:A
本题解析:正丁烷与异丁烷属于同分异构体,所以含有的碳碳键与碳氢键的数目相同,D项错误;正丁烷燃烧放出的热量比异丁烷的能量多,说明正丁烷自身含有的能量高,能量高的物质不稳定。所以A项正确,B项错误,异丁烷转化为正丁烷的反应属于反应物能量小于生成物能量,所以C项为吸热反应。
本题难度:一般