1、选择题 下列说法正确的是
A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂
B.在任何条件下都不能发生Cu+H2SO4=CuSO4+H2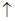 反应
反应
C.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应
D.二氧化氮与水反应的离子方程式是3NO2+H2O=2HNO3+NO
参考答案:A
本题解析:A、正确,HCL中+1价的氢化合价可以降低,具有氧化性,—1价的氯化合价处于最低价,可以升高,具有还原性,所以浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂;B、不正确,用铜作电极通过电解稀硫酸可以实现Cu+H2SO4 CuSO4+H2
CuSO4+H2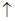 ;C、不正确,还原性I― >Fe2+ >Br― ,分别通入少量氯气,FeBr2中先发生Cl2+2Fe2+=2Fe3++2Cl―,不是置换反应。D、不正确,HNO3是强电解质,应拆开,3NO2+H2O=2H+ +NO3―+NO。选A。
;C、不正确,还原性I― >Fe2+ >Br― ,分别通入少量氯气,FeBr2中先发生Cl2+2Fe2+=2Fe3++2Cl―,不是置换反应。D、不正确,HNO3是强电解质,应拆开,3NO2+H2O=2H+ +NO3―+NO。选A。
本题难度:一般
2、选择题 下列物质中,属于电解质的是
A.蔗糖
B.碳酸钠
C.NaOH溶液
D.金属铁
参考答案:B
本题解析:试题分析:溶于水或在熔融状态下,能够导电的化合物是电解质,在上述情况下均不能导电的化合物是非电解质,所以蔗糖是非电解质,碳酸钠是电解质,氢氧化钠溶液可以导电,但属于混合物,金属铁是单质,不是电解质,也不是非电解质,因此答案选B。
考点:考查电解质的判断
点评:该题是基础性试题的考查,难度不大。该题的关键是要明确,判断电解质的依据是化合物能否自身电离出阴阳离子,而不能依据是否能导电,导电只是一种现象,不能作为判断的依据。该题有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:简单
3、选择题 能正确表示下列反应的离子反应方程式的是
A.Na2O2?溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.将铝粉加入到NaOH溶液中溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
参考答案:C
本题解析:分析:A.原子不守恒;
B.恰好使SO42-沉淀完全,1:2反应,生成硫酸钡、偏铝酸钾;
C.反应生成偏铝酸钠和氢气;
D.反应生成氢氧化铜、氢气.
解答:A.Na2O2?溶于水产生O2的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故B错误;
C.将铝粉加入到NaOH溶液中溶液中的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D.钠与CuSO4溶液反应的离子反应为2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确离子反应的实质、离子反应中保留化学式的物质是解答本题的关键,注意选项D中不能发生置换反应,题目难度不大.
本题难度:困难
4、选择题 某无色透明溶液中,由水电离出来的c(H+) = 1×10-13mol/L,在该溶液中一定能够大量共存的离子组是
A.Fe3+、Al3+、Cl-、HS-
B.K+、Na+、SO42-、NO3-
C.NH4+、AlO2-、Na+、CH3COO-
D.K+、Na+、MnO4-、NO3-
参考答案:B
本题解析:由水电离出来的c(H+) = 1×10-13mol/L,则说明溶液中水的电离是被抑制的,即溶液可能显酸性,也可能显碱性。铁离子在溶液中显棕黄色,MnO4-在溶液中显紫红色,AD不正确。如果溶液显酸性,则选项C中AlO2-、CH3COO-不能大量共存。如果溶液显碱性,则NH4+不能电离共存,所以正确的答案选B。
本题难度:困难
5、选择题 向10mL 0.1mol·L-1 (NH4)Al(SO4)2溶液中滴加等浓度Ba(OH)2溶液x mL。下列表述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+)
B.x=20时溶液导电能力比x=15时溶液导电能力强
C.x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-)
D.x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3?H2O+2H2O
参考答案:AD
本题解析:根据题意,可得相关溶液和沉淀相关图像,a=10, a=15,a=20;

0→a,2Al3++3SO42-+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓?生成氢氧化铝沉淀和硫酸钡沉淀;a→b,SO42-+2NH4++2OH-+ Ba2+=2NH3·H2O+ BaSO4↓;b→c Al(OH)3+OH-=AlO2-+2H2O氢氧化铝溶解;b点为沉淀最大值,相关反应:NH4Al(SO4)2+ 2Ba(OH)2="2" BaSO4↓+ Al(OH)3↓+ NH3·H2O,则此时所耗掉Ba(OH)2的溶液体积为20mL;A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,2Al3++3SO42-+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,溶液中c(NH4+)>c(Al3+),故A正确;选择AD。
本题难度:简单