1、选择题 下列各组物质的燃烧热相等的是
[? ]
A.碳和一氧化碳
B.1mol碳和2mol碳
C.1mol乙炔和2mol碳
D.淀粉和纤维素
参考答案:B
本题解析:
本题难度:简单
2、选择题 某探究小组在某温度下测定溶液的pH值时发现,0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22(mol·L-1)2,则该小组在该温度下测得0.1mol·L-1的NaOH溶液pH值应为(?)
A.13
B.12
C.11
D.10
参考答案:B
本题解析:略
本题难度:简单
3、选择题 常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是
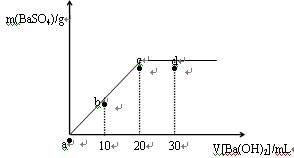
A.硫酸溶液的体积为20 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液的pH约为13
D.溶液的导电能力:c<d<b<a
参考答案:B
本题解析:略
本题难度:简单
4、计算题 在100mL 2.00mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1.00,求产生的沉淀的质量,以及NaHSO4溶液的物质的量浓度(设两种溶液混合时体积变化忽略不计)。
参考答案:反应后溶液的pH是1,所以反应后溶液中的氢离子浓度是0.1mol/L,物质的量为0.1mol.L×0.2L=0.02mol。反应的方程式为:
2NaHSO4+Ba(OH)2=Na2SO4+2H2O+BaSO4↓
2mol? 1mol? 1mol
0.4mol? 0.2mol? 0.2mol
所以硫酸氢钠的物质的量是0.4mol+0.02mol=0.42mol
浓度为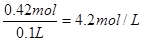
硫酸钡的物质的量是0.2mol
所以质量是0.2mol×233g/mol=46.6g
本题解析:考查pH的有关计算,氢氧化钡和硫酸氢钠混合后会发生反应,根据溶液的pH是1,可知硫酸氢钠是过量的,然后根据方程式列式进行计算即可。
本题难度:一般
5、选择题 下列液体pH>7的是( )
A.人体血液
B.蔗糖溶液
C.橙汁
D.胃液
参考答案:A
本题解析:人体血液pH大于7,蔗糖溶液pH=7,橙汁和胃液的pH小于7,答案选A。
点评:该题是常识性知识的考查,试题贴近生活实际,有利于调动学生的学习兴趣。本题难度不大,记住即可。
本题难度:简单