1、选择题 下列热化学方程式书写正确的是(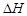 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)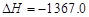 kJ/mol(燃烧热)
kJ/mol(燃烧热)
B.NaOH(aq)+HCl (aq)===NaCl (aq) +H2O(l) kJ/mol(中和热)
kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g)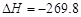 kJ/mol(反应热)
kJ/mol(反应热)
D.Fe+S===FeS kJ/mol(反应热)
kJ/mol(反应热)
参考答案:C
本题解析:A:燃烧产物水为气态,非稳定氧化物,不正确
B:中和反应为放热反应,反应热的值应为负极,不正确
C:正确
D:各物质的状态未标明,不正确
本题难度:简单
2、选择题 下列溶液一定呈酸性的是
A.pH=6的溶液
B.含有H?+的溶液
C.遇酚酞显无色的溶液
D.c(H+)>c(OH-)的溶液
参考答案:D
本题解析:A、如100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,故A错误;
B、水溶液中存在水的电离,一定含有氢离子,与溶液酸碱性无关,故B错误;
C、滴加酚酞后溶液无色,酚酞常温下的变色范围pH为8-10时显浅红色,pH小于8溶液无色,不一定是酸性溶液,故C错误;
D、溶液中c(OH-)<c(H+)溶液一定呈酸性,故D正确;
故选D。
点评:本题考查了溶液PH的计算和溶液酸碱性的判断依据,水的离子积的计算应用,注意不能根据溶液的PH值大小判断溶液酸碱性。
本题难度:简单
3、填空题 (2分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是?。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
D.未用标准液润洗碱式滴定管;
参考答案:CD
本题解析: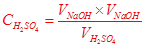 ,只要能引起
,只要能引起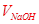 增大的选项即使测定结构偏高。
增大的选项即使测定结构偏高。
本题难度:一般
4、实验题 (1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者?后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍 ,稀释后溶液的pH为(填选项字母,下同)?.
,稀释后溶液的pH为(填选项字母,下同)?.
A.5? B.7 ?C.3~5之间? D.5~7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈?性(填“酸”,“中”或“碱”,下同),溶液中c(Na+)?c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?性,溶液中c(Na+)?c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)?氢氧化钠溶液中c(OH-),m与n的大小关系是m?n。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是?。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。
参考答案:(1)= (2) D (3)碱,?>;(4)酸,<;(5)<,>;(以上每空1分)
(6)A、D、E(多选、错选不得分)(2分)
本题解析:略
本题难度:简单
5、填空题 (14分)
(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为?
已知25 ℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH=10,溶液中各离子的物质的量浓度由大到小的顺序为?。
(2))若100 ℃时,KW=10-12,则100 ℃时pH=11的Ba(OH)2溶液与pH=2的硫酸按体积比1:9混合充分反应后pH=?;若该温度下10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为? ?。
?。
(3)某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示。
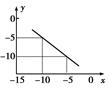
该温度下水的离子积为?。该温度下氯化钠溶液的pH为?
该温度下0.01 mol/L NaOH溶液的pH为?。
参考答案:(14分)每空2分
(1)的体积比为? 1∶9?浓度由大到小的顺序为? c(Na+)>c(A-) >c(OH-) >c(H+)
(2)pH=? 9?; a与b之间应满足的关系为? a+b="13?"
(3)水的离子积为? 10-15 mol2·L-2? pH为? 7.5? ?pH为? 13
?pH为? 13
本题解析:略
本题难度:一般