1、填空题 下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
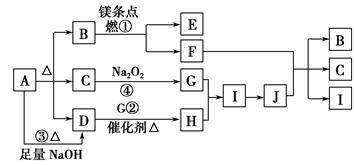
请填写以下空白:
(1)A的化学式?。
(2)定出反应①②的化学方程式:
①?,
②?。
(3)写出反应③的离子方程式:?。
(4)J与F反应的化学方程式:?。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为?mol。
参考答案:(1)NH4HCO3
(2)①2Mg+CO2  2MgO+C
2MgO+C
②4NH3+5O2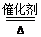 4NO+6H2O
4NO+6H2O
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
(4)C+4HNO3(浓)  CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(5)0.2
本题解析:A分解得到等物质的量的B、C、D,A可能为NaHCO3或NH4HCO3,B与Mg反应,B应为CO2,C与Na2O2反应生成G,C可能为H2O,D与G在催化剂存在的条件下反应,D应为NH3,则H为NO,I为NO2,J为HNO3,HNO3与F反应又生成B (CO2)、C(H2O)、I(NO2),则F为C(碳)。
本题难度:一般
2、选择题 把70%HNO3(密度为1.40 g·cm-3)加到等体积的水中,稀释后硝酸溶液中溶质的质量分数是
A.0.35
B.<0.35
C.>0.35
D.≤0.35
参考答案:C
本题解析:方法1:若将等质量的70%的HNO3与等质量的水混合,稀释后HNO3的质量分数应为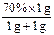 ×100%=35%,若将等体积的70%的HNO3与等体积的水混合,稀释后HNO3的质量分数应为:
×100%=35%,若将等体积的70%的HNO3与等体积的水混合,稀释后HNO3的质量分数应为: ×100%,因为70%的HNO3密度大于水的密度,所以稀释后溶液的质量分数一定大于35%。
×100%,因为70%的HNO3密度大于水的密度,所以稀释后溶液的质量分数一定大于35%。
方法2:将“等体积”转换为“等质量”,则溶液质量分数为0.35,因等体积时,水的密度小于该HNO3的密度,水的质量小于氨水的质量,故质量分数自然要大于0.35。
本题难度:简单
3、选择题 把a L含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用b mol NaOH刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2。则原溶液中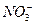 的物质的量浓度(单位mol·L-1)为(? )
的物质的量浓度(单位mol·L-1)为(? )
A.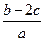
B.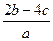
C.
D.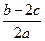
参考答案:B
本题解析:设平分后各含(NH4)2SO4的物质的量为x,NH4NO3的物质的量为y,则有:
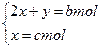 ?解得:y="(b-2c)" mol
?解得:y="(b-2c)" mol
所以原溶液中c(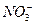 )的浓度为
)的浓度为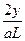 =
=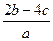 ?mol·L-1。
?mol·L-1。
本题难度:简单
4、实验题 氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有
关性质。
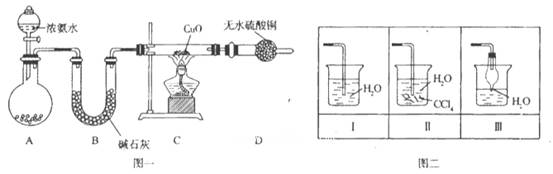
(1)装置A中烧瓶内试剂可选用__________(填序号)。B的作用是_______。
a.碱石灰? b.浓硫酸? C.生石灰? d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_______(填I或Ⅱ)。
I.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为__________________________________________________。?该反应证明氨气具有_________ 性。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_________(填装置序号)。?
(5)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成0.5 L溶液,所得溶液的物质的量浓度为________________mol/L。
参考答案:(1)ac;干燥氨气;(2)Ⅰ ; (3)3CuO+2NH3 3Cu+N2+3H2O;还原性;(4)Ⅱ、Ⅲ;(5)0.2mol/L。
3Cu+N2+3H2O;还原性;(4)Ⅱ、Ⅲ;(5)0.2mol/L。
本题解析:本题考查氨气的制备和性质。(1)由题给装置图分析,装置A为氨气的发生装置,属于固液不加热制气体。a.碱石灰为氧化钙和氢氧化钠的混合物,浓氨水滴加到碱石灰上,会放出大量的热,浓氨水受热分解,产生氨气,正确,b.浓硫酸和氨水反应,不产生氨气,错误;c.生石灰和水反应放出大量热,能使氨水温度升高,促进氨水分解,正确;d.氨气极易溶于水,不能用烧碱溶液制取,错误;选ac;U形管B中装有碱石灰,其作用是干燥氨气;(2)连接好装置并检验装置的气密性后,装入药品,然后应先用氨气排尽装置中空气,应先打开旋塞逐滴向圆底烧瓶中加入氨水,选Ⅰ ; (3)根据题意知,氨气和氧化铜在加热条件下反应生成铜、氮气和水,化学方程式为3CuO+2NH3 3Cu+N2+3H2O;该反应中氮元素的化合价升高被氧化,证明氨气具有还原性;(4)该实验缺少尾气吸收装置,氨气极易溶于水,尾气吸收时要注意防倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ;(5)氨气极易溶于水,标准状况下,2.24 L氨气的物质的量为0.1mol,溶于水配成0.5 L溶液,所得溶液的物质的量浓度为0.2mol/L。
3Cu+N2+3H2O;该反应中氮元素的化合价升高被氧化,证明氨气具有还原性;(4)该实验缺少尾气吸收装置,氨气极易溶于水,尾气吸收时要注意防倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ;(5)氨气极易溶于水,标准状况下,2.24 L氨气的物质的量为0.1mol,溶于水配成0.5 L溶液,所得溶液的物质的量浓度为0.2mol/L。
本题难度:一般
5、选择题 将盛有NO2和O2的混合气体的试管倒扣在水中,充分反应后,试管内充满溶液,则NO2和O2的体积比为
A.1:1
B.3:1
C.4:3
D.4:1
参考答案:D
本题解析:整个试管要充满水,说明最后没有NO,也没有氧气,那么二氧化氮与氧气刚好完全反应。4NO2+O2+H2O=4HNO3。二氧化氮与氧气体积比要满足4比1。答案选D
本题难度:简单