1、实验题 (8分)某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式?。
(2)试设计实验证明溶液X中含过氧化氢?。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:?H2O2 +?Fe2+ +?OH-— ?Fe(OH)3?,该反应中H2O2表现了?性(填“氧化”或“还原”)。
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了?性(填“氧化”或“还原”)。
参考答案:(8分)
(1)2 Na2O2 + 2 H2O = 4 NaOH + O2↑(2分)
(2)取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2(2分)
(3)1、2、4、2(2分);氧化性(1分)
(4)还原性(1分)
本题解析:Na2O2与水反应的化学方程式是2 Na2O2 + 2 H2O = 4 NaOH + O2↑;证明溶液X中含过氧化氢的方法是:取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2;通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:1H2O2 +2Fe2+ +?4OH-=2?Fe(OH)3?,该反应中H2O2表现了氧化性;已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现还原性。2O2与水的反应
点评:有关Na2O2与水的反应的知识来自于教材,此题要结合实验的目的,注意分析实验过程。
本题难度:一般
2、实验题 (16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
 ? 6CuFeS2+19O2
? 6CuFeS2+19O2 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
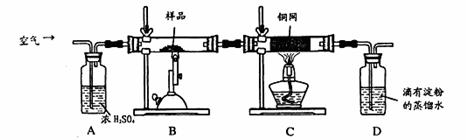
(1)称量该样品时用的仪器的名称为?。
(2)装置A的作用?;
a.有利于空气中氧 气充分反应? b.除去空气中的水份
气充分反应? b.除去空气中的水份
c.有利于气体混合? d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的?。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为?,通过计算,该黄铜矿的纯度为?(Cu:64? Fe:56? S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为?,通过计算,该黄铜矿的纯度为?(Cu:64? Fe:56? S:32)
参考答案:
(1)托盘天平(2分)
(2)b、d(4分,只选一个对的得2分,全对得4分,其它有错的答法不得分)
(3)使生成SO2全部进入 装置,使结果准确(2分)。除去B中多余的O2,防止其氧化D中生成的H2SO3(2分)
装置,使结果准确(2分)。除去B中多余的O2,防止其氧化D中生成的H2SO3(2分)
(4)溶液恰好由无色变成浅蓝色(2分),且半分钟内不褪色(1分) 9 2%(3分)
2%(3分)
本题解析:略
本题难度:简单
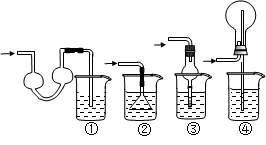
3、实验题 某学生为验证苯酚、醋酸、碳酸的酸性强弱,经过慎重考虑,设计如下实验装置:请回答下列问题
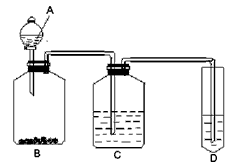
(1)各仪器中所盛放的药品是A______C______D______,(将序号填入横线上 ①苯酚 ②醋酸 ③碳酸
④Na2CO3 ⑤NaHCO3 ⑥苯酚钠)
(2) 装置C的作用____________。
(3) 试描述能证明三种酸的酸性强弱的现象____________。
(4)写出装置D中发生反应的化学方程式__________________。
参考答案:(1)②;⑤;⑥
(2)除去CO2中的氯化氢
(3)B装置中有气泡,D装置溶液变浑浊
(4)C6H5ONa?+CO2+H2O==C6H5OH+NaHCO3
本题解析:
本题难度:一般
4、实验题 氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:

(1)写出氨气与氧化铜反应的化学方程式:?。
(2)在A的锥形瓶中放入NaOH固体的目的是?。
(3)在干燥管B中不能选用的干燥剂是?(填序号);
A.碱石灰
B.生石灰
C.五氧化二磷
D.氢氧化钠
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)?。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)?。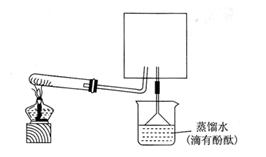
 ??。
??。