1、选择题 某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7.②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤.⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.则关于原溶液的判断中不正确的是( )
A.肯定存在的离子是Na+、K+、SO32-、Br-
B.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响
参考答案:某无色溶液中一定不存在:Fe3+、Cu2+,①pH试纸检验,溶液的pH>7,证明溶液显示碱性,一定含有钠离子或是钾离子中的至少一种,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,则一定不含CO32-,可能含有SO32-,亚硫酸根能被溴水氧化为硫酸根离子,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定含有溴离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明亚硫酸根离子的存在,即是亚硫酸根被氧化生成的硫酸根离子,一定不存在铵根离子,因为二者会双水解而不共存,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子.
A、肯定存在的离子是SO32-、Br-,还有Na+、K+中的至少一种,故A错误;
B、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-,故B正确;
C、在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子,故C正确;
D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则亚硫酸根离子会和BaCl2溶液反应生成难溶物质亚硫酸钡,但是亚硫酸钡是溶于盐酸的白色沉淀,所以对溶液中离子的判断影响,故D错误.
故选AD.
本题解析:
本题难度:一般
2、填空题 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、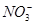 、
、 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为________(填字母)。
A.Br-? B.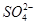
C.CH3COO-? D.
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式:________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是________。
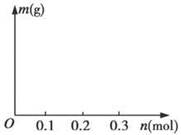
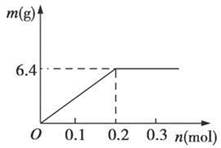
(4)若用惰性电极电解C和D的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阴极析出固体的质量m与通过电子的物质的量n的关系。(标明纵坐标数值)
(5)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________________________。
参考答案:(1)K2CO3 Ba(OH)2
(2)B
(3)3Cu+8H++2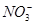 =3Cu2++2NO↑+4H2O 0.4 mol
=3Cu2++2NO↑+4H2O 0.4 mol
(4)如图
(5)2Fe3++2I-=2Fe2++I2
本题解析:(1)五种均为可溶性物质,所以必含有K2CO3,因 与另外四种阳离子形成的物质都是难溶物;由此可知必含有Ba(OH)2,因OH-与另三种阳离子形成的物质都是难溶物。(2)A与C混合产生的蓝色沉淀溶于稀硝酸,且剩余一种不溶于稀硝酸的白色沉淀,所以A为Ba(OH)2、C为CuSO4。(3)由于Cu未溶解,加稀硫酸后产生红棕色气体,所以D为Al(NO3)3,3Cu+8H++2
与另外四种阳离子形成的物质都是难溶物;由此可知必含有Ba(OH)2,因OH-与另三种阳离子形成的物质都是难溶物。(2)A与C混合产生的蓝色沉淀溶于稀硝酸,且剩余一种不溶于稀硝酸的白色沉淀,所以A为Ba(OH)2、C为CuSO4。(3)由于Cu未溶解,加稀硫酸后产生红棕色气体,所以D为Al(NO3)3,3Cu+8H++2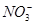 =3Cu2++2NO↑+4H2O,
=3Cu2++2NO↑+4H2O, ,所需硫酸为0.4 mol。(4)阴极上阳离子放电:Cu2++2e-=Cu,转移0.2 mol电子时Cu2+放电完全,得到金属Cu 6.4 g,之后水电离出的H+放电:2H++2e-=H2↑,固体的质量不再变化。(5)由上述推断知E为FeCl3,2Fe3++2I-=2Fe2++I2。
,所需硫酸为0.4 mol。(4)阴极上阳离子放电:Cu2++2e-=Cu,转移0.2 mol电子时Cu2+放电完全,得到金属Cu 6.4 g,之后水电离出的H+放电:2H++2e-=H2↑,固体的质量不再变化。(5)由上述推断知E为FeCl3,2Fe3++2I-=2Fe2++I2。
本题难度:一般
3、选择题 叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3) >c(N3?)>c(H+)>c(OH?)
B.HN3与NH3作用生成的叠氮酸铵是离子化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+)
D.N3?与CO2含相等电子数
参考答案:A
本题解析:A、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-),是弱酸,一小部分电离,显酸性,不正确;B、HN3与作用生成的叠氮酸铵是共价化合物错误,生成物类似醋酸铵啊,是盐,并且是离子化合物;C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+),是弱酸HN3的酸根阴离子,所以在水中要水解,水解的程度较小,水解显碱性,是正确的;D、N3?与CO2含相等电子数,都是22,故正确。
点评:在高考中,考查化学基本概念和理论,是必考的知识点,一般而言,都是把基础的知识点,放在四个选项中,这样做覆盖内容多,面较大,只要理解好了基本的概念和理论,做起题目会相对简单些。
本题难度:一般
4、选择题 ?在强酸溶液中,下列各组离子能够大量共存的是
[? ]
A.Mg2+ 、Ca2+ 、HCO3-、Cl-?
B.Na+、AlO2-、Cl-、SO42-
C.Cu2+ 、Fe3+ 、SO42- 、MnO4-?
D.K+、Fe2+ 、SO42- 、NO3-
参考答案:C
本题解析:
本题难度:一般
5、选择题 在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是
A.NH4+ K+ Na+ CO32- NO3-
B.K+ Na+ Fe2+ SO42- NO3-
C.NH4+ K+ Na+ HCO3-[Al(OH)4]-
D.NH4+ K+ Na+ NO3- I-
参考答案:D
本题解析:根据无色溶液,B项中Fe2+有颜色,不符合题意;A、C不能共存但不发生氧化还原反应,不符合题意;D项中NO3?、H+氧化I?,不能共存,符合题意。
本题难度:一般