1、选择题 有X、Y、Z、W四种主族元素,已知阳离子X、Y和阴离子Z、W具有相同的电子层结构,并且离子半径X>Y,阴离子所带电荷数Z>W.则四种元素的原子序数大小顺序是( )
A.X>Y>Z>W
B.Y>X>Z>W
C.Y>X>W>Z
D.Z>Y>X>W
E.Y>X>W>Z
?
?
?
参考答案:C
本题解析:
本题难度:一般
2、选择题 A、B均为短周期元素.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则下列关于A、B形成的化合物不可能具有的性质是( )
A.能与碳反应
B.能与氢氟酸反应
C.能与碳酸钠反应
D.能与硝酸反应
参考答案:A、B均为短周期元素.A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,所以A有2个电子层,故b=2,所以a=8-2=6,a-b=6-2=4,所以A元素为碳元素,B为硅元素,A、B形成的化合物为二氧化硅.
A、二氧化硅能与碳反应,生成硅与一氧化碳,是制备粗硅的基础,故A正确;
B、二氧化硅化学性质不活泼,能与氢氟酸反应生成四氟化硅与水,氢氟酸是可以与二氧化硅反应的酸,故B正确;
C、二氧化硅能与碳酸钠在高温下反应,生成硅酸钠与二氧化碳,制玻璃中重要的反应,故C正确;
D、二氧化硅不与硝酸反应,氢氟酸是可以与二氧化硅反应的酸,故D错误.
故选D.
本题解析:
本题难度:简单
3、选择题 某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是
[? ]
A.该元素基态原子中共有25个电子
B.该元素原子核外有4个电子层
C.该元素原子最外层共有2个电子
D.该元素原子M电子层共有8个电子
参考答案:D
本题解析:
本题难度:简单
4、选择题 中学化学课本中有大量的数据材料,下面是某学生对数据的利用,其中错误的是( )
A.利用溶解度数据可判断煮沸Mg(HCO3)2溶液时,得到的产物是Mg(OH)2而不是MgCO3
B.利用密度数据可判断液态物质挥发性的大小
C.原子(或离子)半径数据可作为判断某些原子(或离子)的氧化性或还原性的依据
D.利用沸点数据可判断液态物质挥发性的大小
参考答案:A.Mg(HCO3)2加热时易分解,一般情况下生成MgCO3,但在解热时分解生成Mg(OH)2沉淀,说明Mg(OH)2比MgCO3溶解度更小,故A正确;
B.酒精的密度比水小,酒精比水容易挥发,浓硫酸的密度比水大,浓硫酸比水更不容易挥发,所以物质的密度和液体物质挥发性的大小没有必然的联系,故B错误;
C.原子(或离子)半径越大,原子核对最外层电子的吸引力越小,原子(或离子)越易失去电子,还原性越强,则离子的氧化性越弱,故C正确;
D.液体的沸点越低,越易逸出,即液体的挥发性越强,故D正确;
故选B.
本题解析:
本题难度:简单
5、简答题 X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性______强于______.
(2)M、Z、Y形成的简单离子的半径的大小______.
(3)M2X2固体中阴、阳离子个数比______,其电子式为______.该物质中含有化学键的类型有______和______.
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为______.
参考答案:X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,则Y为硫元素,Z为氯元素.根据Y与M可形成化合物M2Y,又因为X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大判断M为钾元素.
(1)Y、Z两种元素的最高价氧化物的水化物分别为H2SO4和HClO4,非金属性S<Cl,非金属性越强,最高价氧化物的水化物酸性越强,故酸性HClO4>H2SO4.
故答案为:HClO4;H2SO4;?
(2)M、Z、Y形成的简单离子分别为K+、Cl-、S2-,它们的核外电子排布相同,核电荷数越大,离子半径越小,故离子半径顺序为S2->Cl->K+.
故答案为:S2->Cl->K+;
(3)M2X2是过氧化钠,由钠离子和过氧根离子构成,阴、阳离子个数比为1:2,电子式为
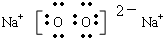
,钠离子与过氧根离子是离子键,过氧根离子中氧原子之间为非极性键.
故答案为:1:2;?
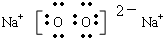
; 离子键;非极性键;
(4)氯气与二氧化硫在水中反应生成盐酸与硫酸,反应离子方程式为Cl2+SO2+2H2O═4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
本题解析:
本题难度:一般