1、填空题 请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积(大于25?mL),并检验Cl2的氧化性。
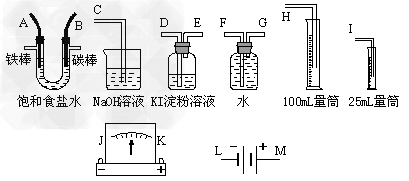
(1)A极发生的电极反应式是_____________,B极发生的电极反应式是____________。
(2)电源、电流表与A、B两极的正确连接顺序为L→?(?)→?(?)→?(?)→?(?)→?M。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。
(4)证明Cl2具有氧化性的实验现象是___________________,其中发生反应的离子方程式是______________________________。
(5)已知饱和食盐水150?mL,电流强度为I?A,通电为t?min时,测得H2体积为16.8?mL(标准状况),此时溶液的pH约为________,阿伏加德罗常数NA的表达式为________________?(电子电量为1.6×10-19C?)。
参考答案:(1)2H++2e-=H2↑;2Cl--2e-=Cl2↑?
(2)J?K?A?B?
(3)H?F?G?D?E?C
(4)KI淀粉溶液变蓝;Cl2+2I-=?I2+2Cl-?
(5)12;?25It×1019
本题解析:
本题难度:一般
2、填空题 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题
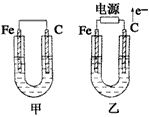
(1)若两池中均为CuSO4溶液,反应一段时间后:
有红色物质析出的是甲池中的_____棒,乙池中的____棒。乙池中阳极的电极反应式是_____________。
(2)若两池中均为饱和NaCl溶液:
写出乙池中总反应的离子方程式____________________。
甲池中碳极上电极反应式是____________________,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”)。
将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___________________。
若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合均匀后的PH=______。
参考答案:(1)碳;铁;4OH--4e-==2H2O+O2↑
(2)2Cl-+2H2O Cl2↑+H2↑+2OH-;2H2O+O2+4e-==4OH-;氧化反应;Cl2+2KI==I2+2KCl;13
Cl2↑+H2↑+2OH-;2H2O+O2+4e-==4OH-;氧化反应;Cl2+2KI==I2+2KCl;13
本题解析:
本题难度:一般
3、实验题 食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下
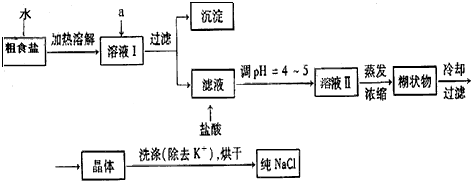
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂。按滴加顺序依次为_________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________
(2)用提纯的NaCl配制500 mL4.00 mol/L。NaCl溶液,所用仪器除药匙、玻璃棒外还有__________________(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2_______(填“>”、“=”或“<”)2L,原因是____________________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________________。
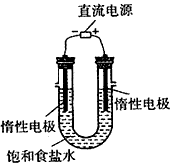
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4==ZnSO4+H2↑ MnO2+4HCl(浓)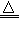 MnCl2+Cl2↑ +2H2O
MnCl2+Cl2↑ +2H2O
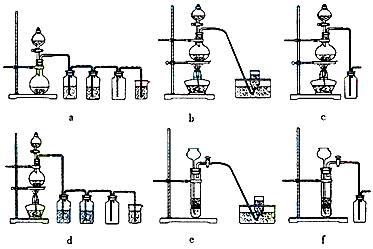
据此,从下列所给仪器装置中选择制备并收集H2的装置___________(填代号)和制备并收集干燥、纯净Cl2
的装置__________(填代号)。可选用制备气体的装置:
参考答案:(1)①BaCl2、NaOH、Na2CO3;②75%乙醇
(2)天平、烧杯、500mL容量瓶、胶头滴管
(3)<;电解生成的氯气与电解生成的NaOH发生了反应;酸碱中和滴定
(4)c;d
本题解析:
本题难度:困难
4、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液 pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成 ClO-,把二价镍氧化为三价镍。以下说法正确的是
[? ]
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应是2Cl--2e-=Cl2↑
D.1mol+2价镍全部变为+3价时,外电路通过1mol电子
参考答案:CD
本题解析:
本题难度:一般
5、选择题 金属铜具有广泛的用途。粗铜电含有少量Fe、Ni、Au 等杂质,可用电解法制备高纯度的铜,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
[? ]
A.电解后,溶液中存在的金属阳离子只有Cu2+
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.阴极发生还原反应,其电极反应式:Cu2++2e-=Cu
D.电解后,电解槽底部的阳极泥中所含的金属单质含有Ni、Ag和Au
参考答案:C
本题解析:
本题难度:一般