1、填空题 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠?钾合金可在核反应堆中用作热交换液。5.05 g钠?钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
_____________________________________________________________
②计算并确定该钠?钾合金的化学式。
_____________________________________________________________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
_________________________________________________________________
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
?
| 氢氧化钠质量(g)
| 氯化钠质量(g)
|
①
| 2.40
| 3.51
|
②
| 2.32
| 2.34
|
③
| 3.48
| 3.51
|
?
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
参考答案:(1)78
(2)①0.75 mol/L?②NaK2
(3)4:5
(4)结论:实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH·H2O。
本题解析:(1)设需要叠氮化钠的质量为x。
2NaN3 2Na+3N2↑
2Na+3N2↑
2 mol×65 g/mol 3 mol×22.4 L/mol
? x 40.32 L
则x=78 g。
(2)①c(OH-)=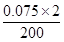 ×1000=0.75 mol/L
×1000=0.75 mol/L
②设上述合金中含a mol钠、b mol钾
a+b=0.075×2
23a+39b=5.05 a=0.050 mol b=0.10 mol
该钠?钾合金化学式为NaK2。
(3)溶液含氢氧化钠。氢氧化钠和二氧化碳反应生成的碳酸钠:
15-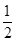 ×24=3 mol
×24=3 mol
112 L二氧化碳的物质的量: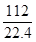 =5 mol
=5 mol
n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5
(4)由氯化钠质量推算,氢氧化钠样品摩尔质量为
M1(氢氧化钠)=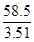 ×2.40=40 g/mol
×2.40=40 g/mol
M2(氢氧化钠)=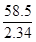 ×2.32=58 g/mol
×2.32=58 g/mol
M3(氢氧化钠)=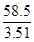 ×3.48=58 g/mol
×3.48=58 g/mol
结论:实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH·H2O。
本题难度:一般
2、选择题 下列有关化学用语使用正确的是
A.CH4分子的比例模型:
B.乙醇的分子式:CH3CH2OH
C.苯的最简式:C6H6
D.乙烯的结构简式:CH2CH2
参考答案:A
本题解析:B中为乙醇的结构简式,不是分子式;C中是分子式,不是结构简式;D中结构简式不能省略碳碳双键;故选A。
本题难度:简单
3、选择题 2011年是国际化学年。下列有关化学用语使用不正确的是 ?(?)
A.硫离子的结构示意图:
B.CCL4的电子式: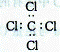
C.质量数为14的氮原子:14N
D.淀粉的分子式:(C6H10O5)n
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (1)写出下列物质的电子式:
①KOH ??②CO2??
(2)用电子式表示下列物质的形成过程:
③Na2S???④H2O ?
参考答案:①?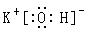 ?②?
?②?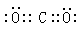 ?
?
③? ?④
?④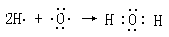
本题解析:①KOH为离子化合物,氢氧之间以共价键结合;②CO2是共价化合物,C、O之间以双键的形式存在;③ Na2S是离子化合物,用电子式表示其形成过程时,要用箭头表示电子的转移方向,且2个钠原子(离子)不能合并书写,阳离子直接用离子符号表示,阴离子要标出电子排布,并用中括号和所带电荷表示;④H2O是共价化合物,共用电子对,故不用箭头表示电子的偏移。
点评:物质的电子式是学习化学的基础,也是高考的常考知识点,考生应掌握常见物质的电子式,并用电子式表示物质的形成过程。
本题难度:一般
5、简答题 500mL某浓度的NaOH溶液恰好与标准状况下的11.2L?CO2完全反应生成正盐.试计算:
(1)生成正盐的物质的量.?
(2)原溶液中NaOH的物质的量浓度.
参考答案:(1)n(CO2)=11.2L22.4L/mol=0.5mol,则
? 2NaOH+CO2=Na2CO3+H2O
? 2mol? 1mol? 1mol
n(NaOH)? 0.5mol ?n(Na2CO3)
n(Na2CO3)=0.5mol,
答:生成正盐的物质的量为0.5mol.
(2)由(1)反应方程式计算可得:n(NaOH)=1mol,
则:C(NaOH)=1mol0.5L=2mol/L,
答:原溶液中NaOH的物质的量浓度为2mol/L.
本题解析:
本题难度:一般