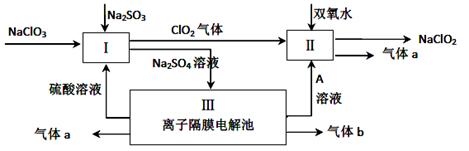
1、选择题 下列说法正确的是(? )
A.升高温度,化学平衡常数一定增大
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.升高温度,活化分子百分数增加,化学反应速率一定增大
D.所有的放热反应都是自发的
参考答案:C
本题解析:正反应不一定是吸热反应或放热反应,所以升高温度,化学平衡常数不一定增大,A不正确;溶液的导电性强弱只与溶液中离子的浓度大小和离子电荷数的多少有关系,而与电解质的强弱并无直接的联系,B不正确;放热反应不一定都是自发进行的,只有满足△G<0的反应产生自发进行的,D不正确,所以正确的答案选C。
点评:该题是高考中的常见题型,试题考查的知识点比较分散,但很基础,难度不大。该题有利于培养学生分析问题、解决问题的能力,特别是灵活应变能力。
本题难度:一般
2、选择题 可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
A.H2、I2、HI的浓度相等
B.H2、I2、HI的浓度保持不变
C.混合气体的密度保持不变
D.混合气体的质量不再改变
参考答案:A.反应达到平衡时各物质的浓度取决于起始配料比以及转化的程度,平衡时各物质的浓度关系不能用以判断是否达到平衡的依据,故A错误;
B.化学反应达到平衡状态时,各物质的浓度不变,故B正确;
C.由于容器的体积不变,气体的质量不变,则无论是否达到平衡状态,气体的密度都不变,故C错误;
D.化学反应遵循质量守恒定律,无论分那英是否达到平衡状态,气体的质量都不变,不能作为判断达到平衡状态的依据,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是( )
①容器内的压强不发生变化
②NO、N2、O2的浓度保持不变
③NO分解的速率和NO生成的速率相等
④单位时间内分解4molNO,同时生成2molN2
⑤混合气体的颜色不再改变的状态
⑥生成NO的速率是生成O2速率的2倍.
A.①③④
B.①④⑥
C.②③⑥
D.②③⑤
参考答案:①该反应是反应气体体积不变的反应,所以无论反应是否达到平衡状态,体系的压强始终不变,故①错误;
②NO、N2、O2的浓度保持不变,达到平衡状态,故②正确;
③NO的正逆反应速率相等,所以达到平衡状态,故③正确;
④单位时间内生成4molNO,同时消耗2molN2,都是正反应速率,不能说明反应达到平衡状,故④错误;
⑤3种气体都是无色气体,无论反应是否达到平衡状态,颜色始终不变,故⑤错误;
⑥当生成NO的速率与生成O2的速率比等于2:l时的状态时,该反应达到平衡状态,故⑥正确;
故选C.
本题解析:
本题难度:简单
4、计算题 (10分)在温度为373K时,把0.25moi NO2气体通入体积为500ml的真空密闭容器中,发生反应:2NO2(g) 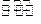 N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
(1)开始时2s内以c (NO2)的变化表示的反应速率是多少?
(2)达到最大限度时体系内的压强是开始的多少倍?
参考答案:(1)0.1mol/L·s?(2)0.8? (各5分)
本题解析:略
本题难度:简单
5、填空题 Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g)?△H<0
CO2(g)+H2(g)?△H<0
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为?。
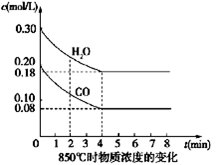
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是?。
A.混合气体的压强
B.混合气体的密度
C.CO的物质的量浓度
D.密闭容器中放出热量