1、推断题 未来的交通工具将采用由新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是化合物G.
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y.G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体.请推断:
①化合物G的化学式为____________.
②由1?mol?NH3和0.75?mol?E恰好完全反应,化合物E的分子式为________.
(2)粉末状G能够分别与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃、水泥、陶瓷的主要原料.G与氧气反应所得的另一种产物是一种单质,G与水反应生成另一种产物是该种单质元素的氢化物.请写出化合物G与水反应的化学方程式:________________________________.
(3)为了使化合物G能成为新一代汽车发动机材料,现在常压下向G中添加氧化铝,高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-xAlxOxY8-x.在接近于1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性.试问:“赛伦”中各元素的化合价为Si________,Al________,O________,Y________.
参考答案:(1)①Si3N4;②SiCl4
(2)Si3N4+6H2O===3SiO2+4NH3↑
(3)+4;+3;-2;-3
本题解析:
本题难度:一般
2、简答题 图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为短周期金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是______,H是______(填化学式).
(2)写出E转化为G的离子方程式______.
(3)写出H在加热下反应生成F的化学方程式______.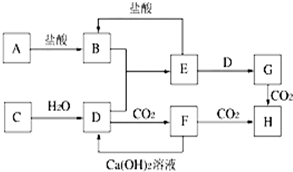
参考答案:C与水反应生成D和最轻的气体,该气体应为H2,D的焰色反应呈黄色,应为NaOH,则C为Na,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应,E应为两性氢氧化物,应为Al(OH)3 ,则A为Al,B为AlCl3 ,F为Na2CO3,G为NaAlO2,H为NaHCO3,则
(1)由以上分析可知B为AlCl3 ,H为NaHCO3,故答案为:AlCl3 ;NaHCO3;
(2)Al(OH)3为两性氢氧化物,与NaOH反应生成NaAlO2,反应的方程式为Al(OH)3 +OH-=AlO2-+2H2O,
故答案为:Al(OH)3 +OH-=AlO2-+2H2O;
(3)H为NaHCO3,加热易分解,反应的方程式为2NaHCO3?△?.?Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3?△?.?Na2CO3+CO2↑+H2O.
本题解析:
本题难度:一般
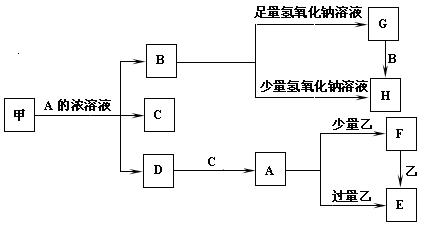
3、填空题 (12分)中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,C在常温下为无色的液体,D是红棕色气体。(图中部分产物和反应条件已略去)
 ?
?
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式_________________________________。
(2)C的电子式是___________________________。
(3)除去G固体中含有H杂质采用的方法是_____________________。
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)_____________________________。
(5)写出由F转化为E的离子方程式____________________________________;
(6)写出由G转化为H的离子方程式____________________________________。
参考答案:(12分)(1)C+4HNO3(浓)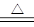 CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)
(2)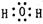 (2分)?(3)加热(2分)
(2分)?(3)加热(2分)
(4)NH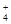 + H2O
+ H2O NH3·H2O + H+ (2分)
NH3·H2O + H+ (2分)
(5)2Fe3+ +Fe 3Fe2+(2分)?
3Fe2+(2分)?
(6)CO32- +H2O +CO2=2HCO3-(2分)
本题解析:综合各物质的颜色状态及各物质的转化关系,可判定甲为碳、A为硝酸:
C+4HNO3(浓)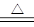 CO2↑+4NO2↑+2H2O (2分)其中的D为NO2、C为H2O、B为CO2;
CO2↑+4NO2↑+2H2O (2分)其中的D为NO2、C为H2O、B为CO2;
硝酸和金属乙的产物与乙的乃是多少有关,可知乙为变价金属,可猜定为铁。
本题难度:一般
4、填空题 A~K是中学化学常见的物质,按如图所示转化关系所得B、C的物质的量相等,请填写下列空白。

(1)A、G的化学式分别是?、?。
(2)写出①、②反应的化学方程式:
①??②?
(3)同温同压下,气体混合物X对氢气的相对密度是?
(4)把少量NaOH溶液滴入足量A的稀溶液中,写出其反应离子方程式:
?
参考答案:(12分)
(1)NH4HCO3?NO
(2)①2Na2O2+2CO2=2Na2CO3+O2?②C+4HNO3(浓) 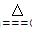 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)13.2
(4)OH-+HCO3-= H2O+ CO32-
本题解析:略
本题难度:一般
5、填空题 物质A~F有如图所示的转化关系。已知A、B、C均为单质,且室温下A为用途广泛的金属、B为黄绿色气体、C为密度最小的无色气体,E为气体,E溶液呈强酸性且无色,D溶液呈黄色。
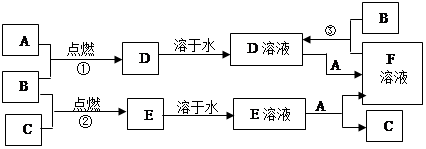
请回答下列问题:
(1)写出下列物质的化学式:A??、B ?、C ??、D ??、E ??、F ??。
(2)写出反应②的化学方程式:??。
(3)写出反应③的离子方程式:??。
参考答案:(1)A:Fe?B:Cl2? C:H2? D:FeCl3 ?E:HCl? F:FeCl2
(2)H2+Cl2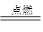 2HCl?(3)2Fe2+ +Cl2=2Fe3++2Cl-
2HCl?(3)2Fe2+ +Cl2=2Fe3++2Cl-
本题解析::B为黄绿色气体,应为Cl2,单质A为用途广泛的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,E溶液与A产物为FeCl2和H2,故F溶液为氯化亚铁溶液。则(1)A:? Fe? B: Cl2? C: H2 ?D: FeCl3 ?E:? HCl? F:FeCl2
(2)②反应为氢气与氯气点燃,反应方程式为H2 +Cl2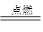 2HCl(3)③反应为氯气与氯化亚铁的反应,离子反应方程式为2Fe2+ ?+Cl2=2Fe3+ +2Cl-
2HCl(3)③反应为氯气与氯化亚铁的反应,离子反应方程式为2Fe2+ ?+Cl2=2Fe3+ +2Cl-
本题难度:一般