1、选择题 对三种金属元素R、U、T进行了如下实验:
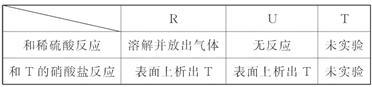
据此可知这三种金属活动性顺序由弱到强的顺序是( )
A.T、R、U
B.T、U、R
C.U、R、T
D.U、T、R
参考答案:B
本题解析:R能和稀硫酸反应生成气体,这说明该气体一定是氢气,而U不能与稀硫酸反应,所以R的金属性强于U的。R、U均能置换出T,所以这三种金属活动性顺序由弱到强的顺序是T、U、R,答案选B。
点评:该题是高考中的常见考点,属于基础性试题的考查,有利于培养学生的逻辑思维能力和发散思维能力。该题的关键是明确金属性强弱比较的依据,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示。下列叙述正确的是(?)
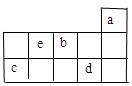
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的单质性质最稳定
C.d气态氢化物的水溶液既有氧化性也有还原性
D.e元素最高价氧化物对应的水化物是一种强酸,保存在无色试剂瓶里
参考答案:C
本题解析:由题目提供的部分元素周期表可知:a是He;b是O;c是Si;d是Cl;e是N。A.O元素除0价外,还有-1、-2两种化合价。错误。B.在这五种元素中,a元素的原子由于处于最外层2个电子的温度结构,所以其单质性质最稳定.错误。C.Cl气态氢化物的水溶液HCl在与比较活泼的金属发生反应时,氢元素得到电子,表现氧化性,在浓HCl与MnO2或KMnO4发生反应时,Cl元素的原子失去电子,表现出还原性。故HCl既有氧化性也有还原性。正确。D.N元素最高价氧化物对应的水化物HNO3是一种强酸,同时也是一种不稳定的酸,见光容易分解,所以要保存在棕色试剂瓶里。错误。
本题难度:一般
3、实验题 A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
 (1)B与D形成化合物BD2的结构式为?,B元素形成的同素异形体的晶体类型可能是?。
(1)B与D形成化合物BD2的结构式为?,B元素形成的同素异形体的晶体类型可能是?。
 (2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式?
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式? ?。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式
?。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式
为___________________________________________。
 (3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为__________________________________________;
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为__________________________________________;
由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)______________________________。
 (4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________________________________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________________________________。
参考答案:(1)O=C=O;原子晶体、分子晶体;
 (2)C + 4HNO3(浓)
(2)C + 4HNO3(浓)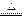 CO2↑+ 4NO2↑+2H2O;
CO2↑+ 4NO2↑+2H2O;
3SO2 + 2NO3? + 3Ba2+ + 2H2O ="=" 3BaSO4↓+ 2NO + 4H+;
 (3)H+ + HSO3? ="=" SO2↑+ H2O;CO32-+ H2O
(3)H+ + HSO3? ="=" SO2↑+ H2O;CO32-+ H2O HCO3-+OH-;
HCO3-+OH-;
 (4)O2 + 2H2O + 4e? ="=" 4OH?;
(4)O2 + 2H2O + 4e? ="=" 4OH?;
本题解析:略
本题难度:简单
4、填空题 (15分)A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,X的结构式为?。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)?。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
?。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。写出石墨(I)电极上发生的电极反应式:?。
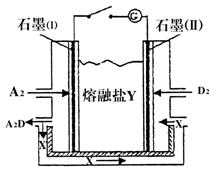
(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为??、W为?。
参考答案:(15分)
(1)O=C=O(2分)?(2)S2->Na+>Al3+?(2分)
(3)SiO2+2C Si+2CO↑?(2分)
Si+2CO↑?(2分)
(4)H2+CO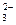 -2e-=H2O+CO2?(2分)(5)0.4 mol (3分,无单位不得分)
-2e-=H2O+CO2?(2分)(5)0.4 mol (3分,无单位不得分)
(6)NaNO2(2分)? NH4NO3(2分)
本题解析:略
本题难度:一般
5、选择题 通过加入适量的化学药品,采用恰当的分离提纯方法,除去某溶液里溶解的杂质,下列做法中不正确?的是(括号内的物质为杂质)
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A、加入过量碳酸钠可以全部沉淀钡离子,过滤后加入稀盐酸到不再产生气体可以除去杂质;
B、加入适量氯化钾可以银离子除去;
C、酒精易溶于水不能分层;
D、加入四氯化碳不溶于水,碘单质在四氯化碳中溶解度大可以萃取分液.
解答:A、加入过量碳酸钠可以全部沉淀钡离子,过滤后加入稀盐酸到不再产生气体可以除去杂质,得到较纯净的氯化钠,故A正确;
B、加入适量氯化钾可以银离子除去,发生AgNO3+KCl=AgCl↓+KNO3,故B正确;
C、酒精易溶于水不能分层,不能进行萃取分液分离,故C错误;
D、加入四氯化碳不溶于水在溶液底层,碘单质在四氯化碳中溶解度大,可以萃取分液,故D正确;
故选C.
点评:本题考查了离子除杂方法,分离混合物的方法应用和实验基本操作,题目较简单.
本题难度:简单