1、选择题 下列说法正确的是
A.强氧化剂与强还原剂不一定能发生氧化还原反应
B.含最高价元素的化合物一定只表现强氧化性
C.阳离子只有氧化性,阴离子只有还原性
D.发生化学反应时,失电子越多的金属原子,还原能力越强
参考答案:A
本题解析:强氧化剂与强还原剂不一定能发生反应,需要一定条件。含最高价元素的化合物不一定只表现强氧化性,如NaCl;如Fe2+具有强还原性;氧化性还原性强弱与得失电子的数目没关系,故答案选A。
本题难度:简单
2、选择题 下列方程式不正确的是
?[? ]
A.将CO2通入过氧化钠中:2Na2O2+2CO2= 2Na2CO3+O2
B.将SO2通入过氧化钠中:2Na2O2+2SO2=2Na2SO3+O2
C.将NO2通入过氧化钠中:Na2O2+2NO2=2NaNO3
D.将SO3的蒸气通入过氧化钠中:2Na2O2+2SO3= 2Na2SO4+O2
参考答案:B
本题解析:
本题难度:简单
3、简答题 已知实验室制氯气的化学方程式为:MnO2+4HCl?(浓)=MnCl2+Cl2↑+2H2O,现用足量浓盐酸在加热条件下跟二氧化锰反应制取氯气.若标准状况下制得Cl22.24L求:
(1)二氧化锰的质量;
(2)把(1)中反应后的溶液稀释到50mL,从中取出10.0mL,加入10.0mL?0.600mol/L的硝酸银溶液,恰好将氯离子完全沉淀.求(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是多少?
参考答案:(1)n(Cl2)=2.24L22.4L/mol=0.1mol,
MnO2+4HCl?(浓)=MnCl2+Cl2↑+2H2O
1? 1
n(MnO2)? 0.1mol
n(MnO2)=0.1mol,
m(MnO2)=0.1mol×87g/mol=8.7g,
答:二氧化锰的质量为8.7g;
(2)n(AgNO3)=0.01L×0.600mol/L=0.006mol,
由反应Ag++Cl-=AgCl↓可知:10.0ml溶液中:n(Cl-)=n(AgNO3)=0.006mol,
则50ml溶液中含有的Cl-物质的量为:0.006mol×5=0.03mol,
所以:(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是:c(Cl-)=0.03mol0.05L=0.6mol/L,
答::(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是0.6mol/L.
本题解析:
本题难度:一般
4、选择题 下列电子式书写错误的是(?)
A.甲基:
B.NH4+: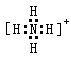
C.CO2: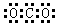
D.H-:
参考答案:C
本题解析:CO2中碳和氧形成的是双键,所以正确的电子式为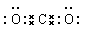 ,C是错误的。其余选项均正确。答案选C。
,C是错误的。其余选项均正确。答案选C。
本题难度:一般
5、选择题 下列化学用语或模型正确的是
A.氯化氢的电子式: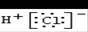

B.N2的电子式: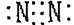
C.硫离子结构示意图: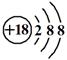
D.次氯酸的电子式: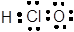
参考答案:B
本题解析:氯化氢是共价化合物,电子式是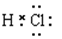 ,A不正确;硫离子的质子数是16个,C不正确;D不正确,应该是
,A不正确;硫离子的质子数是16个,C不正确;D不正确,应该是 ,所以答案选B。
,所以答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要熟练记住。
本题难度:简单