1、选择题 Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
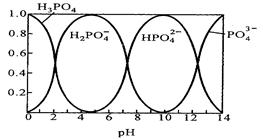
(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
A、C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L
参考答案:
本题解析:
本题难度:困难
2、选择题 已知H2(g)+Br2(l)=2HBr(g),1gH2完全反应放出热量是36KJ ,已知H2(g)的键能是436KJ/mol,HBr(g)的键能是369KJ/mol,则Br2(l)的键能是
A.404 KJ/mol
B.260 KJ/mol
C.230 KJ/mol
D.200 KJ/mol
参考答案:C
本题解析:
答案:C
-36kJ=H2(g)的键能+Br2(l)的键能-2HBr(g)的键能,解得Br2(l)的键能是230 KJ/mol.
本题难度:一般
3、选择题 美国亚利桑那州大学(ASU)和阿贡国家实验室的科学家设计出生产氢气的人造树叶,原理为:2H2O(g)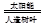 2H2(g)+O2(g)。有关该反应的说法正确的是
2H2(g)+O2(g)。有关该反应的说法正确的是
A.△H <0 B.△S <0
C.化学能转变为电能 D.氢能是理想的绿色能源
参考答案:D
本题解析:A.该反应为水的分解反应,属于吸热反应,即△H>0,A错误;B正反应属于熵增,即△S>0,B错误;C.该反应实现了太阳能转化为化学能,C错误;D氢能属于绿色能源;选D。
考点:考查化学反应的方向等知识
本题难度:一般
4、选择题 未来氢气将作为新能源的优点的是(?)
①燃烧时发生氧化反应? ②充分燃烧的产物不污染环境
③氢气是一种再生能源? ④燃烧时放出大量热量
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:D
本题解析:考查新能源的特点。燃烧都是氧化还原反应,所以选项①不是氢气作为新能源的优点,答案选D。
本题难度:简单
5、选择题 纯净的水呈中性,这是因为?(?)
A.纯水中c(H+)=c(OH-)
B.纯水PH=7
C.纯水的离子积KW=1.0×10-14
D.纯水中无H+也无OH-
参考答案:A
本题解析:略
本题难度:简单