1、选择题 在2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O反应中(? )
A.氧化产物与还原产物粒子个数比是2∶5
B.被氧化的盐酸占参加反应盐酸总数的5/8
C.KMnO4只有一部分发生还原反应
D.KMnO4与HCl恰好分别完全发生还原反应和氧化反应
参考答案:B
本题解析:这是一道部分氧化还原反应的题目,根据电子转移数相等,2个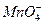 得到10e-,则可氧化10个HCl分子,所以被氧化的盐酸占参加反应盐酸总分子数的5/8。
得到10e-,则可氧化10个HCl分子,所以被氧化的盐酸占参加反应盐酸总分子数的5/8。
本题难度:简单
2、填空题 已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式:?。
(2)此反应的还原剂是___________,它的氧化产物是?。
(3)此反应的离子反应方程式可表示为:________________________________________。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有___________。
参考答案:(1)2MnSO4+5K2S2O8+8H2O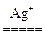 2KMnO4+4K2SO4+8H2SO4
2KMnO4+4K2SO4+8H2SO4
(2)MnSO4? KMnO4
(3)2Mn2++5S2O +8H2O
+8H2O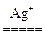 2MnO
2MnO +10SO
+10SO +16H+
+16H+
(4)Cl2(答HClO或HClO3也给分)
本题解析:此题考查了氧化还原方程式的配平及氧化还原反应的基本概念。在反应过程中MnSO4中的Mn元素由+2价被氧化为+7价生成MnO ,故MnSO4为还原剂,其氧化产物为KMnO4。如把MnSO4改为MnCl2,因Mn2+的还原性比Cl-弱,K2S2O8首先氧化Cl-生成Cl2,过量的K2S2O4再氧化Mn2+生成KMnO4。
,故MnSO4为还原剂,其氧化产物为KMnO4。如把MnSO4改为MnCl2,因Mn2+的还原性比Cl-弱,K2S2O8首先氧化Cl-生成Cl2,过量的K2S2O4再氧化Mn2+生成KMnO4。
本题难度:简单
3、选择题 氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O===H2SO4+2HBr相比较,水的作用不同的是
A.2F2+2H2O===4HF+O2
B.Cl2+H2O===HCl+HClO
C.2Na2O2+2H2O===4NaOH+O2↑
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3
参考答案:A
本题解析:在反应Br2+SO2+2H2O===H2SO4+2HBr中,通过化合价对比可知在这个方程式中,水既不是氧化剂也不是还原剂。A选项中,水中氧元素的化合价从-2价升高到0价,水是还原剂,A正确;C选项中氯气发生了歧化反应,氯元素化合价有升有降,水既不是氧化剂也不是还原剂,B错误;C选项中发生化合价变化的是过氧化钠中的氧原子,Na2O2中的氧原子化合价从-1价变为氧气中的饿0价,从-1价变为氢氧化钠中的—2价,水中元素的化合价没有发生变化,水既不是氧化剂也不是还原剂,与已知相同C错误;D中氧气是氧化剂,Fe(OH)2是还原剂,水既不是氧化剂也不是还原剂,与已知相同,D错误;所以答案选A。
本题难度:简单
4、选择题 反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应最终都能使溶液的酸性增强
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO42—>IO3—>I2
D.反应①、2中生成等量I2时转移电子数之比为1:5
参考答案:D
本题解析:本题考查氧化还原反应.
反应①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2中,反应物中有H2SO4这种强酸,而生成物中NaHSO4是种酸式盐,因而反应后酸性是降低的,故A错
反应①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2中,NaI中的 变成的
变成的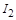 ,其化合价升高,碘元素被氧化,因而B错;
,其化合价升高,碘元素被氧化,因而B错;
在反应①中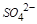 在反应前后各元素的化合价均无变化,因而没有体现其氧化还原的特性,因而C错误;
在反应前后各元素的化合价均无变化,因而没有体现其氧化还原的特性,因而C错误;
反应①中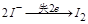 ,生成
,生成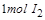 需转移电子数为
需转移电子数为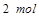 ;反应②中,
;反应②中,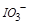 的碘的化合价为
的碘的化合价为 ,所以
,所以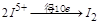 ,生成
,生成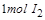 需转移电子数为
需转移电子数为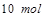 ;故生成等量的时转移电子数之比为
;故生成等量的时转移电子数之比为 .
.
故正确答案为D
本题难度:简单
5、选择题 有相同条件下的三个反应:
①2A-+B2 =2B-+A2?②2C-+A2=2A-+C2? ③2B-+D2=2D-+B2
由此得出,下列判断不正确的是 (?)
A.氧化性:A2 >B2>C2 >D2
B.还原性:C->A->B->D-
C.2A-+D2 =2D-+A2该反应可以进行
D.2C-+B2 =2B-+C2该反应也能进行
参考答案:A
本题解析:反应中氧化剂的氧化性大于氧化产物的氧化性,所以,氧化性:D2 >B2>A2 >C2 ?
还原剂的还原性大于还原产物的还原性?还原性:C->A->B->D-
由此可判断C、D都正确
本题难度:简单