1、选择题 下列各组离子,在指定的环境中能够大量共存的是
A.有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN-
B.滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3-
C.常温下pH=1的溶液中:Na+、K+、Cl-、S2O32-
D.有CO32—存在的无色透明溶液中:Na+、K+、Cl-、AlO2-
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列解释实验现象的反应方程式不正确的是
A.金属Al放入NaOH?溶液中产生大量气泡:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将盛有二氧化氮气体的试管倒立在水中,气体变为无色,有液体进入试管:3NO2+H2O=2HNO3+NO
C.淀粉KI溶液与H2SO4酸化的H2O2溶液混合,溶液变蓝:2I-+H2O2+2H+=2H2O+I2
D.溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
参考答案:D
本题解析:分析:A、金属铝和强碱溶液反应生成偏铝酸盐和氢气;
B、二氧化氮和水反应生成硝酸和无色气体一氧化氮;
C、双氧水具有氧化性,能够将碘离子氧化成碘单质;
D、由于溶液中铝离子和氢氧根离子的物质的量之比是1:4,生成了偏铝酸根离子,没有氢氧化铝沉淀生成.
解答:A、铝和氢氧化钠溶液反应的化学方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,故A错误;
B、二氧化氮和水反应的化学方程式是:3NO2+H2O=2HNO3+NO,故B错误;
C、双氧水能够氧化碘离子,反应的化学方程式是:2I-+H2O2+2H+=2H2O+I2,故C错误;
D、溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,溶液中铝离子和氢氧根离子的物质的量是1:4,生成了偏铝酸根离子,正确离子方程式是:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-↓+2H2O,故D正确;
故选D.
点评:本题考查了化学方程式的书写,注意D项铝离子和氢氧根离子的物质的量的关系,本题难度不大.
本题难度:困难
3、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 (? )
参考答案:C
本题解析:
试卷分析:CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,第一步反应:CO2+Ba(OH)2=BaCO3↓+H2O,第二步反应:CO2+2KOH=K2CO3+H2O,第三步反应CO2+2KAlO2+3H2O=2Al(OH)3↓+K2CO3,第四步反应:K2CO3+CO2+H2O=2KHCO3,第五步反应:BaCO3+CO2+H2O=Ba(HCO3)2。所以图C正确,答案选C。
点评:本题难度较大,要分析好每步的反应才能正确解答。
本题难度:一般
4、填空题 某化学研究性学习小组探讨Fe3+和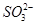 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为____________________________________。
乙同学认为发生双水解反应,其反应方程式为2Fe3++3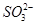 +6H2O===2Fe(OH)3(胶体)+3H2SO3。
+6H2O===2Fe(OH)3(胶体)+3H2SO3。
……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是___?_____。
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:________________?____________。
②实验③中溶液变成血红色的有关离子方程式为_________?____。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是________?__________________。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除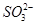 水解能力较
水解能力较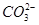 小外,还有_?_______。
小外,还有_?_______。
参考答案:(12分)(1)2Fe3++SO32-+H2O===2Fe2++SO42-+2H+?(2)①BaCl2溶液、稀盐酸
(3)①Fe3+与SO32-同时发生氧化还原反应和双水解反应
②Fe(OH)3(胶体)+3SCN-===Fe(SCN)3+3OH-
(4)①2Fe3++3CO32-+3H2O===2Fe(OH)3↓+3CO2↑
②SO32-有较强的还原性,而CO32-还原性很弱
本题解析:(1)如果发生氧化还原反应,则应该是铁离子氧化SO32-,所以反应的离子方程式是2Fe3++SO32-+H2O===2Fe2++SO42-+2H+。
(2)亚硫酸钠易被氧化生成生成硫酸钠,所以为了检验所用Na2SO3是否变质,应选用的试剂是氯化钡溶液和稀盐酸。
(3)①根据丙中的实验现象可知,反应中有氢氧化铁胶体和硫酸钠生成,这说明Fe3+与SO32-同时发生氧化还原反应和双水解反应。
②③中溶液变成血红色是铁离子的检验,所以有关离子方程式为Fe(OH)3(胶体)+3SCN-===Fe(SCN)3+3OH-。
(4)①观察到红褐色沉淀并且产生无色气体,这说明反应中有氢氧化铁沉淀和CO2气体生成,所以反应的离子方程式是2Fe3++3CO32-+3H2O===2Fe(OH)3↓+3CO2↑。
②根据实验现象可推测,除SO32-水解能力较CO32-小外,还有就是由于SO32-有较强的还原性,而CO32-还原性很弱。
点评:该题是高考中的常见题型,难度较大,试题综合性强,学生不易得分。该试题通过探讨Fe3+和SO32-之间的反应考查学生对氧化还原反应和盐类的水解反应掌握的基本程度,该试题还通过鼓励学生去大胆的猜想及拓展探究实验,考查学生的基本科学素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、选择题 向含有Al3+、Fe2+、Mg2+、NH4+的溶液中,加入过量的NaOH溶液,加热并搅拌,再加过量盐酸,溶液中未减少的阳离子是
[? ]
A.Al3+和Mg2+
B.Al3+和NH4+
C.Fe2+和NH4+
D.只有NH4+
参考答案:A
本题解析:
本题难度:简单