1、选择题 下列各组物质中,都是强电解质的是
A.HBr、HCI、BaSO4
B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2O
D.HClO、NaF、Ba(OH)2
参考答案:A
本题解析:溶于水或熔融状态下,完全电离的化合物是强电解质,A正确。B中醋酸,C中一水合氨,D中次氯酸都是弱电解质,答案选A。
本题难度:简单
2、选择题 以下反应属于吸热反应的是
A.生石灰加水制熟石灰
B.氢氧化钡晶体与氯化铵晶体混合
C.氢氧化钠溶液中滴加稀盐酸
D.化石燃料的燃烧
参考答案:B
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。答案选B。
本题难度:一般
3、选择题 在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀HCl,完全反应后,离子数目几乎没有改变的是( ? )
A.Fe2+
B.Al3+
C.Fe3+
D.NH4+
参考答案:B
本题解析:Na2O2具有强氧化性,可把Fe2+氧化为Fe3+,所以Fe2+数目减少,Fe3+数目增多,Na2O2与H2O反应生成NaOH,NaOH与NH4+反应,使NH4+数目减少,足量的NaOH与Al3+反应生成[Al(OH)4]?,再加入过量的稀HCl,生成Al3+,所以Al3+数目不变,故B项正确。
本题难度:简单
4、填空题 如图所示,在一条鱼.虾几乎绝迹的小河边,从上游到下游依次有甲.乙.丙.丁四座工厂,各厂排放的废水里都只含有Na2CO3.FeCl3.Ca(OH)2.HCl中的一种。某中学环保小组对河水监测时发现:
①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。
请回答
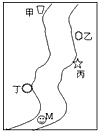
(1)四座工厂排出的废水里含有的污染物分别为:甲_________;乙___________;丙___________;丁
___________。(填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是__________________。
(3)写出有关反应的离子方程式:_______________________________。
(4)小河中鱼.虾几乎绝迹的原因是________________________。
参考答案:(1)Ca(OH)2;FeCl3;HCl;Na2CO3?
(2)Na+、Ca2+、Fe3+、H+、Cl-(OH-)
(3)Fe3++3OH-==Fe(OH)3↓;Fe(OH)3+3H+==Fe3++3H2O;CO32-+2H+==H2O+CO2 ↑
(4)河水中的酸碱性及有害物质的富集,直接危害鱼、虾等生物的生长
本题解析:
本题难度:一般
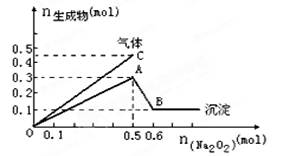
5、选择题 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为
A.2∶1∶2
B.1∶2∶2
C.2∶2∶1
D.9∶2∶4
参考答案:A
本题解析:2Na2O2+2H2O=4NaOH+O2↑? NH4++OH- NH3↑+H2O
NH3↑+H2O
可知,加入的0.5 molNa2O2会产生0.25mol的氧气,而图中共产生0.45mol的气体,所以同时有0.2mol的氨气生成,进而可知原溶液中的NH4+为0.2mol;
图示中由A点到B点,沉淀的物质的量由0.3mol降至0.1mol,可知其中有0.1mol的Mg(OH)2,有0.2mol的Al(OH)3,依据原子守恒可知,原溶液中的Mg2+、Al3+物质的量分别为0.1mol、0.2mol,故原溶液中三种离子的物质的量之比为2∶1∶2,答案为A
本题难度:一般