|
|
|
高中化学知识点大全《影响化学反应速率的因素》典型例题(十)
2020-07-07 23:30:17
【 大 中 小】
|
1、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.滴加少量CuSO4溶液
B.不用稀硫酸,改用98%的浓硫酸
C.对该反应体系加热
D.不用铁片,改用铁粉
参考答案:A、滴加少量CuSO4溶液,铁置换出Cu,构成Fe、Cu原电池,从而加快了生成氢气的反应速率,故A能;
B、因浓硫酸具有强氧化性,铁与浓硫酸反应生成二氧化硫而不生成氢气,故B不能;
C、因加热时反应体系的温度升高,则化学反应速率加快,故C能;
D、改用铁粉,增大了铁与硫酸反应的接触面积,则反应速率加快,故D能;
故选B.
本题解析:
本题难度:一般
2、填空题 .化学反应速率的大小首先取决于反应物本身的 不同.外界条件如 、 、 、 等也会对化学反应的速率产生影响。
参考答案:性质、温度、浓度、压强、催化剂
本题解析:影响反应速率的因素有内因和外因,内因是反应物本身的性质,为主要因素,外界因素有浓度、温度、压强、催化剂、固体的表面积以及溶剂等,故答案为性质、温度、浓度、压强、催化剂
考点:化学反应速率的影响因素
本题难度:一般
3、选择题 一定条件下,体积为2L的密闭容器中,1mol?A和1mol?B进行反应:A(g)+3B(g)?2C(g)经2分钟反应达到平衡,此时生成0.2mol?C.下列说法正确的是( )
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L?min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
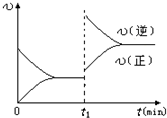
D.若其他条件不变,增大压强,化学反应速率的变化符合下面示意图
| 
参考答案:A、2min平衡时C的物质的量为0.2mol,由方程式可知△n(B)=0.2mol×32=0.3mol,故v(B)=0.3mol2L2min=0.075mol/(L?min),故A错误;
B、平衡时C的物质的量为0.2mol,由方程式可知△n(A)=0.2mol×12=0.1mol,平衡时A的转化率为0.1mol1mol×100%=10%,故B错误;
C、其他条件不变,升高温度,A的体积分数增大,说明平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即△H<0,故C正确;
D、其他条件不变,增大压强,平衡向正反应移动,改变条件瞬间,正、逆速率都增大,且正反应速率增大更多,图象中改变条件瞬间,逆反应速率增大更多,平衡向逆反应移动,图象与实际不符,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下列过程中,需要降低化学反应速率的是
A.制取氨气
B.食物腐烂
C.工业炼钢
D.硫酸的生产
|
参考答案:B
本题解析:对于能为人类的生活和生产有利的反应,一般需要增大反应速率,不利的反应则应降低反应速率,例如金属的腐蚀、食物的腐败、塑料的老化等,选B。
考点:考查化学反应速率的影响因素。
本题难度:一般
5、选择题 某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是
( )
| 反应物
催化剂 | 温度
①
10mL10%?H2O2溶液
无
25℃
②
10mL20%?H2O2溶液
无
25℃
③
10mL20%?H2O2溶液
无
40℃
④
10mL20%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
40℃
|
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的原因不仅仅是实验④加入了催化剂
D.FeCl3不但可以催化H2O2分解,也能催化Zn与盐酸反应制H2
参考答案:A、由表中数据可知,实验④中浓度最高、温度最高且使用催化剂,故反应速率最快,故A正确;
B、由表中数据可知,实验①中浓度最低、温度最低且没有使用催化剂,故反应速率最慢,故B正确;
C、由表中数据可知,实验②、④的不同之处是④中使用催化剂、温度比实验②中高,故实验②速率小于实验④的原因有催化剂、温度的影响,故C正确;
D、催化剂具有专一性,FeCl3可以催化H2O2分解,但不一定是其它反应的催化剂,FeCl3与Zn与发生反应,不能催化Zn与盐酸反应,故D错误.
故选D.
本题解析:
本题难度:简单
