1、选择题 下列说法正确的是
A.甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g)△H=" -890.3" kJ/mol
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
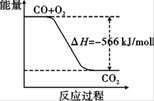
C.已知:2CO(g)+O2(g) ===2CO2(g)ΔH=" -566" kJ/mol,下图可表示由CO生成CO2的反应过程和能量关系
D.已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。已知1个 SF6(g)分子中含有6条S-F键。则:S(s)+3F2(g) ===SF6(g) △H=-1220 kJ/mol
参考答案:D
本题解析:A.甲烷的标准燃烧热生成的产物必须是液态水,故错误;B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故错误;C.已知:2CO(g)+O2(g) ===2CO2(g)?ΔH=" -566" kJ/mol,右图可表示由1molCO生成CO2的反应过程和能量关系,而该方程式表示的是2mol参加的反应,故错误;D、根据反应热等于反应物物键能之各减去生成物的键能之各,可求得是正确的。
本题难度:一般
2、选择题 下列说法正确的是( )
A.化学键断裂放出能量
B.离子化合物中可能含有共价键
C.单质中可能含离子键
D.由分子组成的物质中一定存在共价键
参考答案:A、化学键的断裂吸收能量,化学键的形成放出能量,故A错误;
B、离子化合物中可能含有共价键,如N共价NaOH,化合物中一定不含离子键,故B正确;
C、单质一定不含离子键,可能含金属键,如铁;可能含共价键,如N2;可能不含化学键,如He,故C错误;
D、由分子组成的物质中不一定存在共价键,稀有气体分子,稀有气体是单原子分子,所以不存在化学键,故D错误;
故选B.
本题解析:
本题难度:一般
3、选择题 下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是?
A.NH4Cl  NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2Na2O2+2H2O===4NaOH+O2 ↑
D.2NaOH+Cl2===NaCl+NaClO+H2O
参考答案:C
本题解析:A、NH4Cl中含有离子键和极性共价键,则反应物中只有极性共价键、离子键的断裂,故A错误;反应物和产物中无非极性共价键的断裂和形成;C、Na2O2中含有离子键和非极性共价键,H2O中含有极性共价键,产物NaOH含有离子键和极性键,O2含有非极性键;D、产物中无非极性键的形成。
本题难度:简单
4、填空题 下表为元素周期表的一部分:
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
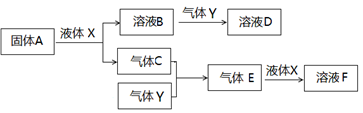
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式 。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是 。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
参考答案:Ⅰ.(1)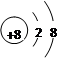 (1分) (2)S2->O2-> Na+(2分) (3)SiCl4
(1分) (2)S2->O2-> Na+(2分) (3)SiCl4
Ⅱ.(4)2Na2O2 +2H2O=4Na+ + 4OH
本题解析:
本题难度:困难
5、选择题 下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石)ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.同一个化学反应,化学计量数不同,ΔH的值不同;化学计量数相同而状态不同,ΔH的值也不同。