1、选择题 在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)?△H=-57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是
N2O4(g)?△H=-57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是
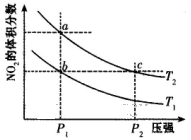
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
参考答案:B
本题解析:A、a、c两点所在的温度相同,但c点的压强高于a点的压强。压强高,反应速率快,因此反应速率为a<c,A不正确;B、a点NO2的体积分数大于b点NO2的体积分数,这说明a、b两点的转化率是a<b,B正确;C、c点的压强高于a点的压强,压强高,容器的容积小,N2O4的浓度大,所以颜色深浅是a浅,c深,C不正确;D、正方应是放热反应,由a点到b点,NO2的体积分数减小,说明平衡向正反应方向移动,因此不能用加热的方法,应该是降低温度,D不正确,答案选B。
本题难度:一般
2、选择题 将Xg纯锌粒和Yg锌粉(含银)同时投入足量的等物质的量浓度、等体积的盐酸溶液中(已知:X>Y).下列叙述正确的为( )
A.开始时的反应速率:V(锌粒)>V(锌粉)
B.溶液温度升高的快慢:T(锌粒)>T(锌粉)
C.最后放出H2的总量:n(锌粒)>n(锌粉)
D.达平衡时正逆反应的速率相等
参考答案:A.锌粉中构成原电池,加快反应速率,则开始时的反应速率:V(锌粒)<V(锌粉),故A错误;
B.锌粉中构成原电池,加快反应速率,则溶液温度升高的快慢:T(锌粒)<T(锌粉),故B错误;
C.X>Y,酸足量,则锌粒生成氢气多,则最后放出H2的总量:n(锌粒)>n(锌粉),故C正确;
D.反应不是可逆反应,金属Zn完全参加反应后,反应停止,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 在5L的密闭容器中进行下述反应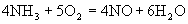 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2)=0.01mol·L-1·s-1
B.V(NO)=0.08mol·L-1·s-1
C.V(H2O)=0.01mol·L-1·s-1
D.V(NH3)=0.002mol·L-1·s-1
参考答案:D
本题解析:V(NO)= 0.3mol÷5L÷30S=0.002mol/(L·S);所以B错误。A V(O2?)=" 5/4×V(NO)=" 5/4×0.002mol/(L·S)= 0.0025mol/(L·S).错误。C.V(H2O)=" 5/4×V(NO)=" 6/4×0.002mol/(L·S)=0.003mol/(L·S).错误。D. V(NH3)=" V(NO)=" 0.002mol/(L·S);正确。
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
参考答案:C
本题解析:
本题难度:一般
5、选择题 一定条件下,可逆反应C(s)+CO2(g) 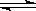 ?2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
?2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④
B.①③
C.②④
D.①③④
参考答案:B
本题解析:①升高反应体系的温度,反应速率加快,正确;②C为固体,增加反应物C的用量,对反应速率无影响,错误;③缩小反应体系的体积,反应速率加快,正确:④减少体系中CO的量,再次达平衡后,反应速率减慢,错误;综上所述,选B。
本题难度:一般