1、选择题 在短周期元素中,原子最外电子层只有1个或2个电子的元素是(?)
A.金属元素
B.非金属元素
C.稀有气体元素
D.无法确定为哪一类元素
参考答案:D
本题解析:在短周期元素中,原子最外电子层只有1个或2个电子的元素可以是第IA或第ⅡA,也可能是0族的He,所以正确的答案是D。
本题难度:一般
2、选择题 下列物质中属于纯净物的是
A.漂白粉
B.食盐水
C.碘酒
D.硫酸铜
参考答案:D
本题解析:
本题难度:简单
3、实验题 某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
?实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)
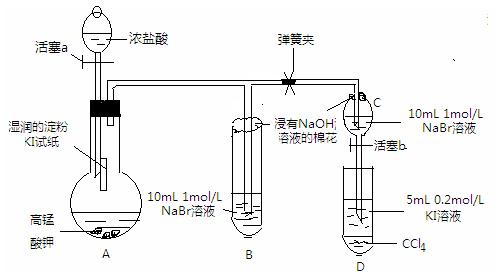 ?
?
实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
⑴验证氯气的氧化性强于碘的实验现象是?,写出该反应的化学方程式?;
⑵为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是?,写出
该反应的离子方程式?;
⑶由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为?;
⑷你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点?
参考答案:

⑷B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄
色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应。(3分)
本题解析:略
本题难度:一般
4、选择题 下列对有关元素的叙述能说明该元素一定是主族元素的是(?)
A.原子核外M层有8个电子的元素
B.原子核外L层比M层多一个电子的元素
C.最高价为+7价的元素
D.无负化合价的元素
参考答案:B
本题解析:原子核外M层有8个电子的元素,不一定是主族元素,例如Ne,A不正确;原子核外L层比M层多一个电子的元素,其原子序数是17,属于主族元素,B正确;C不正确,例如Mn元素的最高价也是+7价;D不正确,例如稀有气体元素,没有负价,答案选B。
点评:该题是中等难度的,试题基础性强,侧重能力的培养和解题方法的训练与指导。该题的关键是明确周期表的结构,并能灵活运用,有利于培养学生的逻辑推理能力。
本题难度:一般
5、填空题 在原子序数1—18号元素 中,按要求用合适的化学用语填空:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是___________。
(4)最稳定气态氢化物的化学式是______________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_______________。
参考答案:(1)Na(或钠)。(2)? F2?(3) H(4) HF?(5)? HClO4
本题解析:(1)与水反应最剧烈的金属是Na(或钠);(2)与水反应最剧烈的非金属单质是F2 ;
(3)原子半径最小的元素是 H ;(4)最 稳定气态氢化物的化学式是 HF;(5)最高价氧化物对应水化物的酸性最强的化学式是 HClO4?。
点评:本题考查了元素周期表、元素周期律,该知识点是高考考查的重点和难度,本题属于对基础知识的考查,本题比较简单。
本题难度:一般