1、填空题 (10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
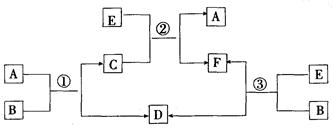
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为?,其中A的化学式是?。
(2)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是?
(3)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应①的离子方程式是?。在反应③中,若生成1 molD,则转移电子数目为?。
参考答案:(1)EAD? Br2?(2)3Fe+4H2O(g)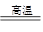 Fe3O4+4H2
Fe3O4+4H2
(3)2Na2O2+2H2O=4Na++4OH-+O2↑? 2NA?(每空2分,共10分)
本题解析:本题是无机框图题,关键是找准突破点。
(1)A、D、E为卤素单质,所以根据置换反应①②③可知,E是氯气,A是溴,D是单质碘。因此A、D、E的氧化性由强到弱的顺序为EAD。
(2)C是一种有磁性的化合物,则C是四氧化三铁,所以A是铁,D是氢气,反应①的化学方程式是3Fe+4H2O(g)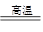 Fe3O4+4H2。
Fe3O4+4H2。
(3)若B为一种淡黄色固体,则B是过氧化钠,所以D是氧气,E是CO2,A是水,所以反应①的方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。过氧化钠中氧元素的化合价是-1价,所以生成1mol氧气转移电子是2NA。
本题难度:一般
2、选择题 X、Y、Z是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,下列说法错误的是
A.X或Y均能使湿润的淀粉碘化钾试纸变蓝
B.1molY或Z与足量水完全反应时,均转移1mol电子
C.Z为离子化合物,但含有共价键,阴、阳离子个数比为1:2
D.X和Y均能用向上排空气法和排水法收集
参考答案:D
本题解析:能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂的有色物质主要有NO2、Cl2、Na2O2,按照摩尔质量可以确定X为NO2,Y为Cl2,Z为Na2O2。X、Y均具有强氧化性,所以能使湿润的碘化钾淀粉试纸变蓝,A正确;1molY和Z与足量的水发生反应时转移的电子数均为1mol,B正确;Z为离子化合物,含有Na+和O22-,所以含有共价键,且阴阳离子个数比为1:2,C正确;X能与水发生3NO2+H2O=2HNO3 +NO,所以不能用排水法收集,D错误。答案选D。
点评:本题为推断题,主要考查学生分析问题的能力,难度较大。
本题难度:简单
3、填空题 某些化学反应可用下式表示(未配平):A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,写出该反应的离子方程式:______.
(2)若A为紫红色金属,D为无色刺激性气体,请写出符合上式的化学方程式:______.
(3)若C、D均为气体(其中C有颜色)且分子具有相同的原子个数比,则符合上式化学方程式是:______.
参考答案:(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,应是歧化反应,氯气与强碱的反应符合转化关系,反应离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)A为紫红色金属,A是Cu,生成D为无色刺激性气体,应是Cu与浓硫酸反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑;
(3)若C、D均为气体(其中C有颜色)且分子具有相同的原子个数比,应是碳与浓硝酸反应生成二氧化碳、二氧化氮与水,反应方程式为:C十4HNO3(浓)△.CO2↑+4NO2↑+2H2O,
故答案为:C十4HNO3(浓)△.CO2↑+4NO2↑+2H2O.
本题解析:
本题难度:一般
4、填空题 有A、B、C、D四种无色气体,
①A能使湿润的红色石蕊试纸变蓝;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;
③D与A混合生成白烟;
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;按要求回答下列问题:
(1)写出②化学方程式______;
(2)写出④的离子方程式______;
(3)气体E有毒,实验室一般用______吸收,该反应的离子方程式是______.
参考答案:①A能使湿润的红色石蕊试纸变蓝;是氨气的特征性质,判断为NH3;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;红棕色气体为NO2,判断C为NO,
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;推断D为浓盐酸,黄绿色气体E为Cl2;
③D与A混合生成白烟;说明A为NH3,B为O2,;
综上所述判断出的物质为:A为NH3;B为O2;C为NO;D为HCl;E为Cl2;
(1)反应②是氨气的催化氧化生成一氧化氮和水,一氧化氮和空气中氧气反应生成红棕色气体二氧化氮,反应的化学方程式为:4NH3+5O2催化剂.△4NO+6H2O;2NO+O2=2NO2
故答案为:4NH3+5O2催化剂.△4NO+6H2O;2NO+O2=2NO2;
(2)反应④是实验室制备氯气的反应生成氯化镁、氯气、水,反应的离子方程式为:MnO2+4H+?△?.?Mn2++Cl2↑+2H2O;故答案为:MnO2+2Cl-+4H+?△?.?Mn2++Cl2↑+2H2O;
(3)气体E为氯气有毒不能排放到空气中污染环境,需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;故答案为:NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O;
本题解析:
本题难度:一般
5、填空题 (12分)
下列框图表示各有关物质之间的转化关系,所有反应物、生成物及溶液中的水均未标出。已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1molB隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。
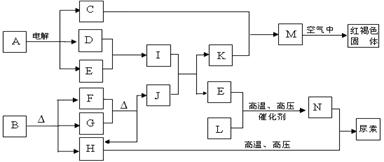
请回答下列题:
(1)构成单质J的元素在周期表中的位置是?。
(2)B的化学式?;? N的空间构型是?。
(3)写出M在空气中变为红褐色固体的化学方程式?。
(4)D与E反应可制得一种重要的化工原料I,其反应的现象是?。
(5)N与H在高温高压下能合成尿素[CO(NH2)2],其反应的化学方程式为?
?。
参考答案:共12分
(1)第四周期Ⅷ族?(2分)
(2)FeC2O4?三角锥?(各2分)
(3)4Fe(OH) 2+O2+2H2O==4Fe(OH)3?(2分)
(4)苍白色火焰,放出大量热?(2分)
(5)2NH3 + CO2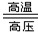 CO(NH2)2+ H2O?(2分)
CO(NH2)2+ H2O?(2分)
本题解析:略
本题难度:一般