1、选择题 在制氯气时有如下操作:操作顺序正确的是
①连接好装置,检查气密性②缓缓加热,加快反应,使气体均匀逸出③在圆底烧瓶中加入二氧化锰粉末④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中⑤将多余的氯气用氢氧化钠溶液吸收⑥用向上排空气法收集氯气
A.①②③④⑤⑥
B.③④②①⑥⑤
C.①③④②⑥⑤
D.①③②④⑥⑤
参考答案:C
本题解析:制取氯气的顺序应按发生装置、除杂装置、收集装置、尾气处理装置,所以正确顺序为:①连接好装置,检查气密性,③在圆底烧瓶中加入二氧化锰粉末 ,④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中,②缓缓加热,加快反应,使气体均匀逸出, ⑥用向上排空气法收集氯气 ,⑤将多余的氯气用氢氧化钠溶液吸收
本题难度:一般
2、选择题 下列实验设计和结论正确的是?
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动,所以溶液是电中性的,胶体是带电的
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42—
D.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
参考答案:D
本题解析:选项A不正确,乙醇与水互溶,不能作萃取剂;选项B不正确,胶体也是电中性的,胶体的胶粒是带电荷的;选项C不正确,也可能含有SO32-,因为在酸性条件下,NO3-能氧化SO32-生成SO42-,所以正确的答案选D。
本题难度:一般
3、选择题 下列实验操作中有错误的是
A.萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出;
B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中;
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出;
D.鉴别SO42-时的操作顺序是先加入BaCl2溶液,再加稀盐酸。
参考答案:D
本题解析:A正确,萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出;B正确,用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中;C正确,蒸馏中,冷却水应从冷凝管的下口通入,上口流出;D错,鉴别SO42-时的操作顺序是先加入稀盐酸酸化,再加BaCl2溶液,若有白色沉淀生成,则有硫酸根离子;
本题难度:一般
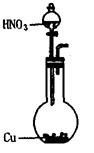
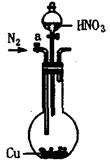
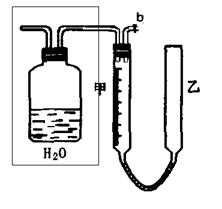
4、实验题 (13分)可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。
 ?
? ?
?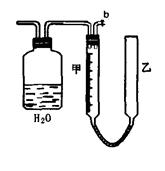
A? B?C
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择?(填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。
(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是?。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二?。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是?。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为n?mol,则用含n和V的式子表示m=?(结果可不必化简)。
参考答案:(13分)?(1)B(2分)
(2)(2分)
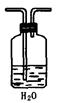
(3)将C中的溶液加适量水稀释(2分)
(4)第二,打开a,通足量N2,排净装置中的空气(2分)
(5)向下移动乙管,使甲、乙两管液面在同一水平面上(2分)
(6)(V-11.2n)/33.6n (3分)
本题解析:略
本题难度:一般
5、选择题 在下列实验方法 合理的是
合理的是
A.可用水鉴别K2SO4、NaOH、NaCl三种固体
B.可用铁粉除去FeCl2溶液中的少量的CuCl2
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必须相等
参考答案:B
本题解析:略
本题难度:一般