1、选择题 下列说法中,正确的是
A.35Cl、37 Cl为互为同位素,有不同的化学性质
B.氯气和二氧化硫使品红褪色的原理相同
C.浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低
D.卤化氢在空气中都能形成白雾,它们都是强电解质
参考答案:C
本题解析:A、35Cl、37 Cl为互为同位素,有不同的物理性质,但化学性质相似,A不正确;B、氯气和二氧化硫使品红褪色的原理不相同,前者是氧化还原反应,后者是非氧化还原反应,B不正确;C、浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低,前者由于浓硝酸的挥发,后者是浓硫酸的吸水,C正确;D、HF是弱电解质,D不正确,答案选C。
本题难度:一般
2、选择题 将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1 mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为 (?)?
A.0.8mol
B.1.6mol
C.2mol
D.4mol
参考答案:A
本题解析:HBr的还原性比SO2小,所以,通入1 mol Cl2时,氯气先与二氧化硫反应,二氧化硫反应完全后再与HBr反应;设混合气体中二氧化硫的物质的量为x,由方程式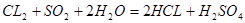 可得,x mol二氧化硫要消耗x mol氯气,由方程式
可得,x mol二氧化硫要消耗x mol氯气,由方程式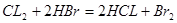 可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=
可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=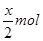 ,得x=0.8mol
,得x=0.8mol
本题难度:一般
3、填空题 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式?;
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为?;
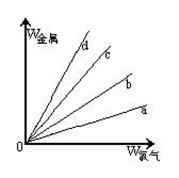
(3)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是?,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的?。
参考答案:(1)MnO2 + 2Cl-+ 4H+ Mn2+ + Cl2↑+ 2H2O( 2分)
Mn2+ + Cl2↑+ 2H2O( 2分)
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O? (2分)?(3)b (2分)? Na(2分)
本题解析:(1)实验室制取氯气的化学方程式为MnO2 + 2Cl-+ 4H+ Mn2+ + Cl2↑+ 2H2O。
Mn2+ + Cl2↑+ 2H2O。
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(3)Cl2与四种金属反应的均为氧化还原反应,在横坐标上取一点作一条垂直于横坐标的直线,分别与a、b、c、d四条直线的交点即为四种金属与等质量Cl2反应时所需的质量。假设这一点的体积为标准状况下的22.4L,此时金属均转移2mol电子,则消耗四种金属的质量分别为:WNa=46g、WCu=64g、WAl=18g、WFe=37.3g,即等质量氯气消耗四种金属的质量是WCu>WNa>WFe>WAl,故a、b、c、d分别代表Al、Fe、Na、Cu与氯气的反应,即代表铁与Cl2反应的直线是b;如果横轴表示消耗掉的硫的质量,则根据方程式2Na+S=Na2S、2Al+3S=Al2S3、Fe+S=FeS、2Cu+S=Cu2S,假设消耗硫都是1mol,则需要金属的质量分别为:WNa=46g、WCu=128g、WAl=18g、WFe=56g,即等质量氯气消耗四种金属的质量是WCu>WFe>WNa>WAl,则b表示的是四种金属中的钠。
本题难度:简单
4、填空题 (12分)下列框图中的A—J是中学化学中常见的八种物质,所有物质均由短周期元素组成,已知常温、常压下D为无色液体, C、E、G均为气体单质,B为金属,I是由3个原子组成的一元含氧弱酸分子, A—J可发生如下转化:
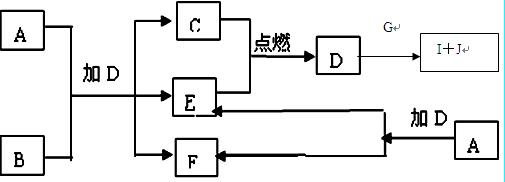
请填写下列空白:
⑴G的名称为?,F的电子式为?。
⑵15.6gA与D完全反应,转移的电子的物质的量为?。
⑶常温下,A为一种?色的固体,它的一种重要用途是? ?。
?。
⑷写出D、G反应转化为I和J的离子方 程式?
程式? ?。
?。
参考答案:

本题解析:略
本题难度:困难
5、填空题 (10分)如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
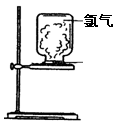
(1)对此反应及现象的描述正确的是?
A.此反应为放热反应
B.白烟的生成说明产生了氯化钠分子
C.反应中钠元素被氧化,氯元素被还原。
(2)写出该反应的方程式?
(3)用电子式表示氯化钠的形成过程?,
(4)检验有Cl-生成,请补充实验步骤(可填满也不可填满)
①倒转集气瓶,加适量蒸馏水
②取少量溶液于试管中。
③加试管中加入?。
④有?生成则证明有Cl-。
参考答案:(1)AC?(2)2Na+Cl2="=2NaCl" (点燃)
(3)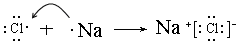
(4)硝酸银(或答硝酸酸化的硝酸银)、白色沉淀
本题解析:氯气具有强氧化性,钠是活泼的金属,二者化合生成氯化钠,属于放热反应。氧化钠是离子化合物,不是分子,其形成过程为 。B是错误的。答案选AC;检验氯离子一般用硝酸酸化的硝酸银,现象是产生白色沉淀。
。B是错误的。答案选AC;检验氯离子一般用硝酸酸化的硝酸银,现象是产生白色沉淀。
本题难度:简单