|
高中化学知识点归纳《影响化学反应速率的因素》试题强化练习(2019年最新版)(八)
2020-07-07 23:38:58
【 大 中 小】
|
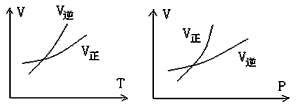
1、选择题 可逆反应mA(g)  nB(g)+ pC(s),温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是 nB(g)+ pC(s),温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是
[? ]
A.m>n,正反应放热
B.m>n+p,正反应放热
C.m>n,正反应吸热
D.m<n+p,正反应吸热
参考答案:A
本题解析:
本题难度:一般
2、选择题 对于反应2SO2+O2 2SO3,下列变化可增大活化分子百分数而使反应速率加快的是 2SO3,下列变化可增大活化分子百分数而使反应速率加快的是
①增大压强 ②升高温度 ③增大O2浓度 ④使用催化剂
A.①③
B.①④
C.②③
D.②④
|
参考答案:D
本题解析:①增大压强,可增大单位体积的活化分子数,加快反应速率,但没有增大活化分子百分数,不选①;②升温可以增大活化分子百分数,加快反应速率,选②;③增大氧气的浓度,可增大单位体积内活化分子数,加快反应速率,但不能增大活化分子百分数,不选③;④使用催化剂,可以降低活化能,增大活化分子百分数,加快反应速率,选④。所以选D。
考点:条件对反应速率的影响。
本题难度:一般
3、选择题 工业生产硫酸时,其中一步反应是2SO2 + O2 ?2SO3,下列说法正确的是 ?2SO3,下列说法正确的是
A.增大氧气的浓度不能提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.达到化学平衡时正逆反应速率相等且都为零
参考答案:BC
本题解析:增大反应物的浓度可以加快化学反应速率,故增大氧气的浓度能提高反应速率,所以A错误;温度升高可以加快化学反应速率,所以B正确;使用催化剂可以显著增大反应速率,故C正确;达到化学平衡时正逆反应速率相等为一恒定值,不可能为0,所以D错误,所以本题的答案选BC。
点评:本题考查了化学平衡的知识,该知识点是高考考查的重点和难点,本题要注意的是达到化学平衡时正逆反应速率相等为一恒定值,不可能为0。
本题难度:一般
4、填空题 (9分)某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
实验序号
| 双氧水体积
| 双氧水浓度
| 添加的物质
| 待测数据X
| 1
| 100mL
| 20%
| 无
|
| 2
| 100mL
| 20%
| 10gMnO2
|
| 3
| 100mL
| 20%
| 10gKI
|
| 4
| 100mL
| 20%
| 新鲜猪肝
|
|
(1)在该研究方案中,MnO2、KI和猪肝在双氧水分解的过程中可能起到 的作用。
(2)待测数据X为 。
(3)以下措施可以加快该实验中双氧水分解速率的是: (填标号)。
A.将双氧水的体积增大至200mL
B.将双氧水的浓度增大至30%
C.对装置A加热
D.上下移动B装置使量气管内气体压强增大
(4)从控制变量的原理来看,该方案是否合理 (填“是”或“否”)。理由是:
参考答案:(共9分):(1)催化剂(或催化或改变化学反应速率或增大化学反应速率)(2分)
(2)生成50mL气体所需的反应时间(2分)(3)B、C(2分)
(4)否(1分)新鲜猪肝的质量应选用10g(2分)
本题解析:(1)由于其它条件相同,只是加入的MnO2、KI和猪肝不同,因此在该研究方案中,MnO2、KI和猪肝在双氧水分解的过程中可能起到催化剂的作用;(2)双氧水分解会产生氧气,因此待测数据X为生成50mL氧气需要的时间;(3)由于影响化学反应速率的因素有浓度、温度,升高温度,化学反应速率会加快,增大反应物的浓度,化学反应速率加快;对于有气体参加的反应,中的压强,化学反应速率会加快;对于有固体参加的反应,其浓度不变,但是增大固体接触面积反应速率也会加快。综上所述,可以加快该实验中双氧水分解速率的是B、C;(4) 从控制变量的原理来看,该方案不合理,原因是2、3加入的物质都是10g,4的实验中新鲜猪肝的质量应选用10g,不能没有质量的多少,故不合理。
考点:考查化学实验方案的设计与评价、影响化学反应速率的因素的知识。
本题难度:一般
5、实验题 (12分)为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。

已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol?L-1,只有NO生成。当铜片与5 mol?L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
时间/min
| 现象
| 0~15
| 铜表面出现气泡,但速度很慢
| 25
| 溶液有很浅的蓝色,气泡生成速度加快
| 30
| 气泡生成速度较快,均匀冒出
| 45
| 洗气瓶中可见少量淡棕色的物质
| 50
| 溶液中蓝色明显变深,洗气瓶中突显明显棕色
|
(4)获得图2数据所需的测量仪器有________________________________。
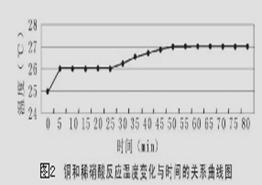
(5)从上述图表分析可得到的结论是 。
序号
| 温度
| 铜片/g
| 硝酸/mL
| 硝酸铜/g
| 1
| 25℃
| ①
| ②
| ③
| 2
| 25℃
| 5
| 20
| 0.5
| 3
| 25℃
| 5
| 20
| 1.0
|
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 。
参考答案:(1)利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰 (2分) (2)3Cu +8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O (2分)
(3)B瓶溶液变为棕黄色;B瓶溶液出现棕色 (各1分,共2分)
(4)温度计和秒表(或使用pH传感器) (2分)
(5)反应溶液温度升高不是使反应速率加快的主要因素(2分)
(6)5;20;0 (1分) (7)研究NO对反应速率的影响 (2分)
本题解析:(1)由于装置中含有空气,能氧化生成的NO,所以实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,二者反应生成CO2,利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰。
(2)铜片和稀硝酸反应的化学方程式为3Cu +8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O。
(3)本实验A生成的气体中,若有NO2,NO2溶于水生成硝酸,硝酸具有强氧化性,能氧化亚铁离子为铁离子,所以B的实验现象为B瓶溶液变为棕黄色;若只有NO生成,由于FeSO4+NO=[Fe(NO)]SO4,则B的实验现象是B瓶溶液出现棕色。
(4)根据图像可知需要测量温度和时间,因此需要的仪器是温度计和秒表。
(5)根据图像可知温度升高后反应速率增加的程度不是很大,这说明反应溶液温度升高不是使反应速率加快的主要因素。
(6)要研究化学反应产物对反应速率的影响,则反应物铜片和硝酸应该是相铜的,即①中铜片质量为5g;②中硝酸的浓度是体积20ml;根据2、3可知1中硝酸铜为0。
(7)由于生成物不止一种,所以为达到实验目的还需要继续进行的实验是研究NO对反应速率的影响。
考点:考查外界条件对反应速率影响的实验方案设计与研究
本题难度:困难
| 